
【题目】化学与科学、技术、社会、环境(STSE)密切联系。下列说法错误的是( )
A.新冠病毒可用75%乙醇、次氯酸钠溶液、过氧乙酸![]() 进行消毒,其消毒原理相同
进行消毒,其消毒原理相同
B.生产N95口罩的主要原料聚丙烯是一种高分子化合物
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.聚乙烯是生产食品保鲜膜、塑料水杯等生活用品的主要材料,不能用聚氯乙烯替代
科目:高中化学 来源: 题型:
【题目】把温度为20 ℃,浓度为1.0 mol/L的H2SO4溶液和2.2 mol/L的碱溶液各50 mL混合[溶液密度均为1g/mL,比热容为4.18 kJ/(kg·℃)]轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1 ℃ | 终止温度t2 ℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
(1)反应NH3·H2O(aq)![]() NH4+ (aq)+OH-(aq)的焓变约____。
NH4+ (aq)+OH-(aq)的焓变约____。
(2)计算上述两组实验测出的中和热:ΔH1=___kJ/mol;ΔH2=__kJ/mol。
(3)由本题结论可预测将第1组中的1 mol/L的H2SO4溶液换成2mol/L的CH3COOH溶液进行实验,测得的中和热数值__(填“大于”“小于”或“等于”)56.848。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:(本题无计算过程不给分)
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。______
(2)溶液稀释后,c(H+)是多少?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2和2molH2(g)置于某2L密闭容器中,在—定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为 _______。H2(g)的平衡转化率为___________。
在此温度下,该反应的平衡常数K__________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是______(填入下列条件的序号。下同),乙条件可能是________。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是_______________ (用含一个a、b、c的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁代表4种纯净物。甲(g)+2乙(g) ![]() 丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列说法正确的是
丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列说法正确的是
A. 甲(g)的能量一定大于丙(g)的能量
B. 该反应不需要加热
C. 1 mol甲(g)与2 mol乙(g)的总能量高于1 mol丙(g)和1 mol丁(g)的总能量
D. 在一密闭容器中充入1 mol 甲(g)与2 mol 乙(g),在一定条件下反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
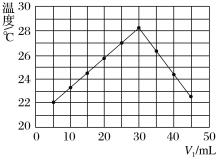
A.该实验表明化学能可以转化为热能
B.做该实验时环境温度为22℃
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示甲、乙是电化学实验装置。
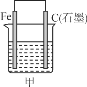
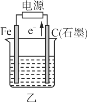
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________。
②乙中总反应的离子方程式为____________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为__________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com