
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
【答案】20%; 2.28mol/L; 2.48mol; 4mol/L; 8.96L。
【解析】
(1)根据溶质的质量分数的计算公式![]() ,以及溶液的稀释定律(稀释前后溶质的质量、物质的量不变)计算混合后溶质的质量,且混合后溶液质量不变,据此计算混合后溶液中KNO3的质量分数;已知溶液的密度、溶质的质量分数,利用公式
,以及溶液的稀释定律(稀释前后溶质的质量、物质的量不变)计算混合后溶质的质量,且混合后溶液质量不变,据此计算混合后溶液中KNO3的质量分数;已知溶液的密度、溶质的质量分数,利用公式![]() 计算溶质的物质的量浓度;
计算溶质的物质的量浓度;
(2)设需要硝酸钾物质的量为xmol,根据m=nM计算出硝酸钾的质量,根据(1)中溶液中溶质的质量分数及![]() 进行计算;
进行计算;
(3)根据n=V/Vm计算HCl的物质的量,再根据c=n/V计算其物质的量浓度;根据n=cV计算100mL该溶液中HCl的物质的量,再根据反应方程式:HCO3- + H+ = H2O + CO2↑,计算与足量NaHCO3反应生成CO2气体在标准状况下的体积。
(1)混合后溶液的质量为m(溶液)=20.0g+30.0g=50.0g,溶质硝酸钾的质量:m(溶质)= 20.0g×14%+30.0g×24%=10.0g,则混合后溶质的质量分数为:![]() ,溶质的物质的量浓度为:
,溶质的物质的量浓度为:
![]()
故答案为:20%;2.28mol/L;
(2)设需要硝酸钾物质的量为xmol,则硝酸钾的质量为101xg,则溶液的质量为(1000+101x)g,该溶液浓度恰好与上述混合溶液的浓度相等,则该溶液的质量分数也为20%,![]() ,解得:x≈2.48mol;
,解得:x≈2.48mol;
故答案为:2.48mol;
(3)标准状况下44.8LHCl的物质的量为![]() ,则其浓度为
,则其浓度为![]() ,100mL该溶液中氢离子物质的量n(H+)=cV=4mol/L×0.1L=0.4mol,与足量NaHCO3反应的方程式为:HCO3- + H+ = H2O + CO2↑,则生成0.4mol CO2,V(CO2)=nVm=0.4mol×22.4L/mol=8.96L;
,100mL该溶液中氢离子物质的量n(H+)=cV=4mol/L×0.1L=0.4mol,与足量NaHCO3反应的方程式为:HCO3- + H+ = H2O + CO2↑,则生成0.4mol CO2,V(CO2)=nVm=0.4mol×22.4L/mol=8.96L;
故答案为:4mol/L;8.96L。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)可作半导体材料的元素是 ______(填元素符号);气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐的元素是 _____(填名称);
(2)第三周期中离子半径最小的是___________(填离子符号);
(3)① ~ ⑨的最高价氧化物的水化物中:酸性最强的是 __________(填化学式);碱性最强的是________(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为__________。
(4)⑧、⑨可形成A2B2型的化合物,分子中二者均满足8电子稳定结构,则其电子式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法错误的是
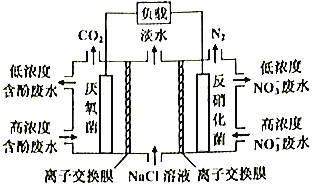
A. 左室电极为该电池的负极
B. 右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O
C. 左室电极附近溶液的pH增大
D. 工作时中间室的Cl-移向左室,Na+移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在不同物质的同种元素之间的是
A. 2H2S+SO2=3S↓+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. CuO+H2SO4=CuSO4+H2O
2KCl+3O2↑D. CuO+H2SO4=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置说法正确的是

A. 装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B. 若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C. 若M为FeCl2溶液,可以实现石墨上镀铁
D. 若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com