ЃЈ2011?ГЏбєЧјЖўФЃЃЉЕЊЦјЪЧжЦБИКЌЕЊЛЏКЯЮяЕФвЛжжживЊЮяжЪЃЌЖјЕЊЕФЛЏКЯЮягУЭОЙуЗКЃЎ
ЃЈ1ЃЉЯТУцЪЧРћгУЕЊЦјЕФвЛжжЭООЖЃК

Й§ГЬЂђЕФЛЏбЇЗНГЬЪНЪЧ
ЃЎ
ЃЈ2ЃЉАБЦјЕФжЦБИгыдЫЪфЙ§ГЬжаЖМгабЯИёвЊЧѓЃЎ
ЂйКЯГЩАБЪБЃЌЮТЖШЙ§ИпЃЌАБЦјЕФВњТЪНЕЕЭЃЌЪдДгЛЏбЇЦНКтвЦЖЏдРэЕФНЧЖШМгвдНтЪЭ
КЯГЩАБЕФЗДгІЪЧвЛИіЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђЩњГЩЕЊЦјКЭЧтЦјЕФЗНЯђвЦЖЏЃЌДгЖјЪЙАБЦјЕФВњТЪНЕЕЭ
КЯГЩАБЕФЗДгІЪЧвЛИіЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђЩњГЩЕЊЦјКЭЧтЦјЕФЗНЯђвЦЖЏЃЌДгЖјЪЙАБЦјЕФВњТЪНЕЕЭ
ЃЎ
ЂкдЫЪфЪБЃЌбЯНћгыТБЫиЃЈШчCl
2ЃЉЛьзАдЫЪфЃЎШєЖўепНгДЅЪБОчСвЗДгІВњЩњАзбЬЃЌЧв0.4mol NH
3ВЮМгЗДгІЪБга0.3mol e
-зЊвЦЃЎаДГіЗДгІЕФЛЏбЇЗНГЬЪН
8NH3+3Cl2=6NH4Cl+N2
8NH3+3Cl2=6NH4Cl+N2
ЃЎ
ЂлЙЄвЕЩЯвВПЩдкМюадШмвКжаЭЈЙ§ЕчНтЕФЗНЗЈЪЕЯжгЩN
2жЦШЁNH
3ЃК
2N
2+6H
2O
4NH
3+3O
2ЭЈШыN
2ЕФвЛМЋЪЧ
вѕМЋ
вѕМЋ
ЃЈЬюЁАвѕМЋЁБЛђЁАбєМЋЁБЃЉЃЌбєМЋЕФЕчМЋЗДгІЪНЪЧ
4OH--4e-=O2Ёќ+2H2O
4OH--4e-=O2Ёќ+2H2O
ЃЎ
ЃЈ3ЃЉвбжЊЃК4NH
3ЃЈgЃЉ+3O
2ЃЈgЃЉЈT2N
2ЃЈgЃЉ+6H
2OЃЈgЃЉЁїH=-1316kJ/mol
АБЪЧвЛжжЧБдкЕФЧхНрФмдДЃЌПЩгУзїМюадШМСЯЕчГиЕФШМСЯЃК
ЂйФмРћгУИУЗДгІЩшМЦГЩЕчГиЕФдвђЪЧ
ИУЗДгІЮЊздЗЂЕФЁЂЗХШШЕФбѕЛЏЛЙдЗДгІ
ИУЗДгІЮЊздЗЂЕФЁЂЗХШШЕФбѕЛЏЛЙдЗДгІ
ЃЎ
ЂкШМСЯЕчГиЕФИКМЋЗДгІЪНЪЧ
2NH3-6e-+6OH-=N2Ёќ+6H2O
2NH3-6e-+6OH-=N2Ёќ+6H2O
ЃЎ








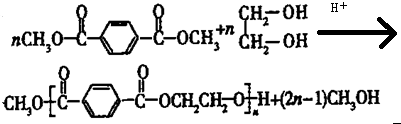
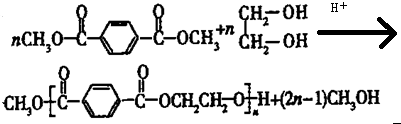
 КЯГЩ
КЯГЩ ЕФСїГЬЭМЃЎЃЈзЂУїЗДгІЬѕМўЃЉ
ЕФСїГЬЭМЃЎЃЈзЂУїЗДгІЬѕМўЃЉ