
| A、CH3COONa(固体) |
| B、NH4Cl(固体) |
| C、CuSO4(溶液) |
| D、Ba(OH)2(固体) |


科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,可确定有Cl-存在 |
| B、用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有Na+ |
| C、加入HCl溶液,生成无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥⑦ | B、②③⑤⑦ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )| A、该温度下此反应的平衡常数为3.2 |
| B、A的初始物质的量为4 mol |
| C、反应到达平衡时,放出的热量是193kJ |
| D、反应达平衡时,A的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
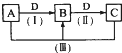 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com