
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 15:2 C. 3:1 D. 1:3
科目:高中化学 来源: 题型:
【题目】常温下,在水溶液中发生如下反应:①16H++10C-+2XO![]() ===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是( )
===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是( )
A. 反应C2+2A2+===2A3++2C-可以进行
B. 反应③是置换反应
C. 氧化性由强到弱的顺序是XO![]() >C2>B2>A3+
>C2>B2>A3+
D. 还原性由强到弱的顺序是C->A2+>B->X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( ) 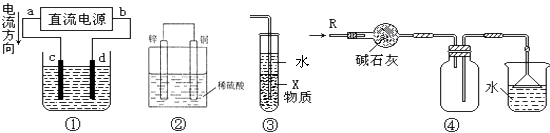
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组因发生氧化还原反应而不能大量共存的是
A.Ag+、SO42-、HCO3-、Cl-B.Mg2+、Cl-、Na+、OH-
C.K+、MnO4-、H+、Fe2+D.Ba2+、Cl-、NH4+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
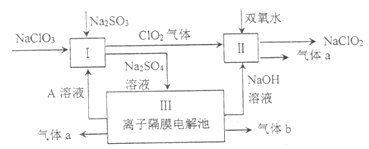
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
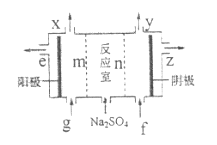
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:

下列说法正确的是( )
A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示步骤分开五种离子。下列判断正确的是

A.沉淀乙是氢氧化铝和氢氧化银的混合物
B.溶液3中含有Al3+
C.试剂①是NaCl,试剂④是H2SO4
D.溶液4含有三种阳离子,分别是H+、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com