
【题目】下列离子组因发生氧化还原反应而不能大量共存的是
A.Ag+、SO42-、HCO3-、Cl-B.Mg2+、Cl-、Na+、OH-
C.K+、MnO4-、H+、Fe2+D.Ba2+、Cl-、NH4+、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质,但类比是相对的,不能违背客观实际。下列说法中,不正确的是
A. CO2通入水中生成H2CO3,SO2通入水中生成H2SO3
B. CO2通入CaCl2溶液中无明显现象,SO2通入CaCl2溶液中也无明显现象
C. 足量的CO2通入到澄清石灰水中,先生成沉淀后溶解,足量的SO2通入到澄清石灰水中现象相同
D. CO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]() ,SO2通入
,SO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
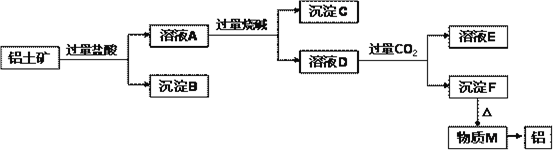
请回答下列问题:
⑴图中涉及分离溶液与沉淀的实验方法是__________(填操作名称)。
⑵沉淀B的成分是___________(填化学式,下同);沉淀C的成分是___________;溶液D中大量存在的阴离子是___________。
⑶沉淀F转化为物质M的化学方程式为___________;由物质M制取铝的化学方程式为___________;溶液D中通入过量CO2生成沉淀F的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]() 。将一定量的
。将一定量的![]() 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
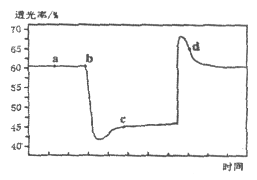
A. b点的操作是压缩注射器
B. c点与a点相比, ![]() 增大,
增大, ![]() 减小
减小
C. 平均摩尔质量: ![]()
D. d点: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH的Ba(OH)2、NaOH和NH3H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V1=V2>V3
D.V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的![]() 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的![]() 、
、![]() 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
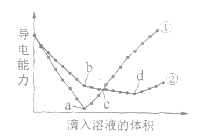
A. ①代表滴加![]() 溶液的变化曲线
溶液的变化曲线
B. b点,溶液中大量存在的离子是![]() 、
、![]()
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同量的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 15:2 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO32-)=______mol·L1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_________________;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是___________________________;
(4)写出③中固体加入足量盐酸洗涤的离子方程式________________________________。
Ⅱ.四种物质有如下相互转化关系:

(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为____________________;
(6)若甲是活泼金属,化合物B是强碱,则该反应的离子方程式为____________;
(7)若乙是黑色固体,化合物B是优质的耐高温材料。则该反应的化学方程式为____________________;
(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料。则该反应的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com