
【题目】Ⅰ.某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO32-)=______mol·L1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_________________;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是___________________________;
(4)写出③中固体加入足量盐酸洗涤的离子方程式________________________________。
Ⅱ.四种物质有如下相互转化关系:

(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为____________________;
(6)若甲是活泼金属,化合物B是强碱,则该反应的离子方程式为____________;
(7)若乙是黑色固体,化合物B是优质的耐高温材料。则该反应的化学方程式为____________________;
(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料。则该反应的化学方程式为____________________。
【答案】 1 ≥2 molL1 取少量原溶液置于试管中,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子 BaCO3+2H+=Ba2++H2O+CO2↑ 2Al+Fe2O3![]() 2Fe+Al2O3 2Na+2H2O=2Na++2OH-+H2↑(或2K+2H2O=2K++2OH-+H2↑) 2Mg+CO2
2Fe+Al2O3 2Na+2H2O=2Na++2OH-+H2↑(或2K+2H2O=2K++2OH-+H2↑) 2Mg+CO2![]() 2MgO+C SiO2+2C
2MgO+C SiO2+2C![]() Si+2CO↑
Si+2CO↑
【解析】无色溶液中不存在Fe3+,①第一份加入AgNO3溶液有沉淀产生,则Cl-、CO32-和SO42-至少含有一种;②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下),气体是氨气,物质的量是0.02mol,因此含有0.02mol NH4+;③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g,所以一定存在CO32-和SO42-,因此不能存在Ca2+。其中硫酸根的物质的量是2.33g÷233g/mol=0.01mol,碳酸钡的质量是4.30g-2.33g=1.97g,则碳酸根离子的物质的量是1.97g÷197g/mol=0.01mol。
(1)c(CO32-)=0.01mol÷0.01L=1.0 mol·L1;(2)根据电荷守恒可知阴离子所带电荷数大于阳离子所带电荷数,所以该溶液中一定存在K+。铵根的浓度是2.0mol/L,硫酸根的浓度是1.0mol/L,由于氯离子不能确定,则K+浓度范围是≥2 molL1;(3)根据以上实验可知氯离子可能存在,检验该离子是否存在的方法是取少量原溶液置于试管中,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子;(4)③中固体加入足量盐酸洗涤时碳酸钡溶解,反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑。(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应是金属铝与氧化铁的铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;(6)若甲是活泼金属,化合物B是强碱,则该反应是钠或与水的反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑或2K+2H2O=2K++2OH-+H2↑;(7)若乙是黑色固体,化合物B是优质的耐高温材料,则该反应是镁在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2
2Fe+Al2O3;(6)若甲是活泼金属,化合物B是强碱,则该反应是钠或与水的反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑或2K+2H2O=2K++2OH-+H2↑;(7)若乙是黑色固体,化合物B是优质的耐高温材料,则该反应是镁在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2![]() 2MgO+C;(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料,则该反应是碳与二氧化硅的反应,反应的化学方程式为SiO2+2C
2MgO+C;(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料,则该反应是碳与二氧化硅的反应,反应的化学方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。


科目:高中化学 来源: 题型:
【题目】下列离子组因发生氧化还原反应而不能大量共存的是
A.Ag+、SO42-、HCO3-、Cl-B.Mg2+、Cl-、Na+、OH-
C.K+、MnO4-、H+、Fe2+D.Ba2+、Cl-、NH4+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示步骤分开五种离子。下列判断正确的是

A.沉淀乙是氢氧化铝和氢氧化银的混合物
B.溶液3中含有Al3+
C.试剂①是NaCl,试剂④是H2SO4
D.溶液4含有三种阳离子,分别是H+、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A、B、C、D、E是常见单质,其中B、C、E为金属.G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性. 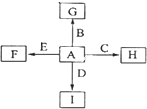
已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;
②I是一种常见的温室气体,它和E可以发生反应:2E+I ![]() 2F+D,F中E元素的质量分数为60%.回答问题:
2F+D,F中E元素的质量分数为60%.回答问题:
(1)C与G反应的化学方程式为;
(2)单质A的分子式为 , 化合物I的名称为;
(3)C与NaOH溶液反应的化学方程式为;
(4)过量I与NaOH溶液反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是( )
A.AgI比AgCl稳定
B.氯的非金属性比碘强
C.I﹣的还原性比Cl﹣强
D.AgI的溶解度比AgCl小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父“徐光宪在《化学分子共和国》中介绍了许多物质,下列有关说法不正确的是
A. 固态CO2 俗称干冰,大量排放易造成温室效应
B. 碘单质“望酸碱而逃”指:碘单质遇碱歧化为I-和IO3-,再遇酸归中成碘单质
C. CO会引起煤气中毒,冬天用煤进行取暖时,在屋内放置一盆水,就可以有效防止中毒
D. NO自述“诞生在闪电的弧光中,强大的能量造就了我”指:高压放电情况下,N2和O2生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属银、熔融硫和多硫化锂分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列关于其说法错误的是
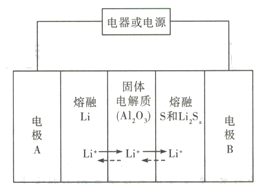
A. 放电时,电极B为正极
B. 充电时内电路中Li+的移动方向为从B到A
C. 该电池的适宜工作温度应该在Al2O3的熔点和沸点之间
D. 充电时,阳极反应为Sx2--2e-=xS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com