
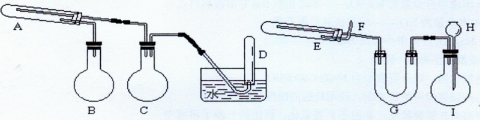

 4H2+Fe3O4;试管A是铁与水蒸气反应的装置,故在A中装的应该是普通铁粉,在反应过程中 要生成氢气,所以D是用来收集氢气的,烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流从而在试管和收集气体的试管中间加上了广口瓶,保证实验安全;A中是铁和水蒸气的反应;B中为产生水蒸气的装置,C为安全瓶防止倒吸的作用,D中收集的是氢气,
4H2+Fe3O4;试管A是铁与水蒸气反应的装置,故在A中装的应该是普通铁粉,在反应过程中 要生成氢气,所以D是用来收集氢气的,烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流从而在试管和收集气体的试管中间加上了广口瓶,保证实验安全;A中是铁和水蒸气的反应;B中为产生水蒸气的装置,C为安全瓶防止倒吸的作用,D中收集的是氢气, 3Fe+4H2O;由于使用的是稀盐酸来制取氢气,所以在产生氢气的同时可能带出部分水蒸气和氯化氢气体,故在U型管中加入固体来干燥气体,吸收氯化氢和水蒸气,所以U型管中为固体NaOH(或碱石灰、CaO等碱性固体干燥剂),
3Fe+4H2O;由于使用的是稀盐酸来制取氢气,所以在产生氢气的同时可能带出部分水蒸气和氯化氢气体,故在U型管中加入固体来干燥气体,吸收氯化氢和水蒸气,所以U型管中为固体NaOH(或碱石灰、CaO等碱性固体干燥剂), 3Fe+4H2O,故答案为:Fe3O4+4H2
3Fe+4H2O,故答案为:Fe3O4+4H2 3Fe+4H2O;
3Fe+4H2O;

科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
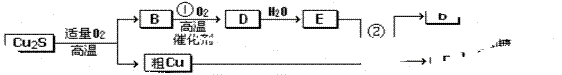
 适量的空气冶炼金属铜的化学方程式__________________________
适量的空气冶炼金属铜的化学方程式__________________________ 4+12H2SO4
4+12H2SO4 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
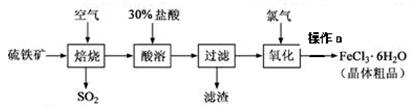
 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。| A.玻璃棒 | B.烧杯 | C.托盘天平 | D.500mL量筒 |
 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O。
H2O。 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所得沉淀为0.05 mol的BaSO4 | B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol | D.a的取值范围为0.672<a<0.896 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.56(3x+y)g | B.56(3x-y) g | C.28(3x+y)g | D.28(3x-y)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com