
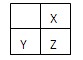
| A.X、Z的高价态氧化物性质相似 |
| B.工业上常用电解法生产Y的单质 |
| C.原子半径的大小顺序为rX<rY<rZ |
| D.元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
科目:高中化学 来源:不详 题型:填空题
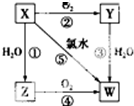
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径 A> B> D> C | B.原子序数 d > c> b> a |
| C.离子半径 C> D> B> A | D.单质的还原性 A> B> D> C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.分子中含有氢键 | B.属于非极性分子 |
| C.含有4个σ键和1个π键 | D.该氢化物分子中,②原子采用sp2杂化 |
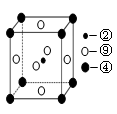
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A | | | | | | | | | | | | | | | | | He |
| | | | | | | | | | | | | | | C | D | | |
| | E | | | | | | | | | | | F | | | | H | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
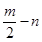 。请回答下列问题:
。请回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子层数逐渐增多 | B.原子半径逐渐增大 |
| C.最高正化合价数值逐渐增大 | D.从硅到氯负价从-1 →-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com