
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
【答案】D
【解析】
A.容器I中的反应

化学平衡常数K=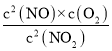 =
=![]() =0.8;
=0.8;
容器II中开始时浓度商Qc=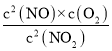 =
=![]() =
=![]() <0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
<0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
B.容器I中反应平衡时c(O2)=c(NO2),如果容器II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3-x=0.2+0.5x,解得x=![]() ,平衡时 c(NO2)=c(O2)=
,平衡时 c(NO2)=c(O2)=![]() mol/L,c(NO)=0.5mol/L+
mol/L,c(NO)=0.5mol/L+![]() mol/L=
mol/L=![]() mol/L,II中Qc=
mol/L,II中Qc=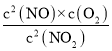 =
= ≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中
≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中 ![]() <1,而容器I中
<1,而容器I中 ![]() =1,所以达平衡时,容器Ⅱ中
=1,所以达平衡时,容器Ⅱ中 ![]() 比容器Ⅰ中的小,故B错误;
比容器Ⅰ中的小,故B错误;
C.若容器Ⅲ在某时刻,NO的体积分数为50%,可得反应的三段式:
2NO2(g)2NO(g)+O2(g)
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2y 2y y
平衡量(mol/L) 2y 0.5-2y 0.35-y
若0.5-2y=2y+0.35-y,解得y=0.05,求出此时浓度商Qc=![]() =4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
=4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
D.υ正=υ(NO2 )消耗=k正c2(NO2 ),υ逆=υ(NO)消耗=2υ(O2 )消耗
故答案为D。


科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶休,结构如图所示,有关说法不正确的是
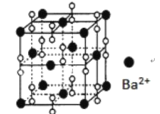
A.该晶体属于离子晶体
B.该晶体晶胞结构与NaCl相似
C.晶体的化学式为Ba2O2
D.与每个Ba2+距离相等且最近的 Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由相同金属电极及其不同浓度的盐溶液组成的电池称为浓差电池,电子由溶液浓度较小的一极流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。 进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流计指针偏转。下列不正确的是

A.充电前,该电池两电极不存在电势差
B.放电时,右池中的NO3-通过离了交换膜移向左池
C.充电时,当外电路通过0.1 mol电子时,两电极的质量差为10.8 g
D.放电时,电极Y为电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的有几项:
①lmolCl2做氧化剂时得到的电子效为2NA
②25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
③过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
④50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
⑤利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图)。若原料完全反应,得到1mol产物同时生成3NA个H2O

A. 0 B. 1 C. 2 D. 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:

![]() 如图三个反应中,属于氧化还原反应的有______个.
如图三个反应中,属于氧化还原反应的有______个.
![]() 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
A.还原性:![]() B.酸性:
B.酸性:![]()
C.稳定性:![]() C.沸点:
C.沸点:![]()
![]() 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性![]() 答题必须用具体物质表示
答题必须用具体物质表示![]() .
.
![]() 化合物B的电子式为______;其水溶液呈碱性的原因是______
化合物B的电子式为______;其水溶液呈碱性的原因是______![]() 用离子方程式表示
用离子方程式表示![]() .
.
![]() 化合物B可与
化合物B可与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,则反应Ⅰ的热化学方程式为______
,则反应Ⅰ的热化学方程式为______![]() 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
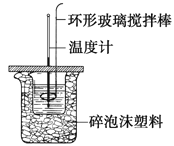
步骤一:用量筒量取50ml 0.50 molL-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 molL-1NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LSO3含有的氧原子个数为1.5NA
B.100g34%的双氧水中含有H—O键的数目为2NA
C.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D.16.8gFe粉与足量水蒸气完全反应,转移的电子数目为0.8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com