
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
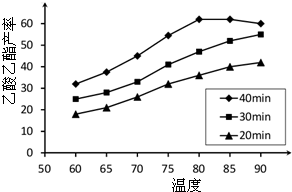
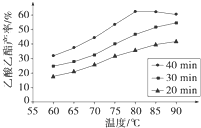
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。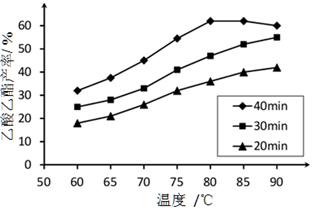
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(10分)
(1)探究反应温度、反应时间对乙酸乙酯产率的影响 (2分)
(自变量、因变量有遗漏或表达不清,扣1分)
(2)小于(2分)(“<”得1分)
(3)反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降(2分)
(4)①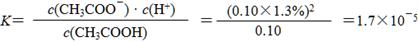 (2分)
(2分)
(因计算时未作近似处理使小数在1.69~1.71之间均不扣分)
②1.7×10-2 (2分)
(“1.69×10-2~1.71×10-2”或用小数表示均不扣分)
解析试题分析:(1)根据图中信息可以得出此实验的目的是探究反应温度、反应时间对乙酸乙酯产率的影响。
(2)温度越高,反应速率越大,故前者的平均反应速率小于后者。
(3)ΔH=-8.62kJ·mol-1,即反应为放热反应,达到平衡时化学反应逆向移动。故乙酸乙酯产率下降的原因可能是反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降。
(4)①经过公式计算得: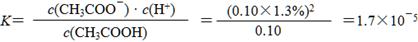 。
。
考点:化学反应速率的影响因素 化学平衡移动 电离平衡常数计算
点评:本题考查的是化学反应速率的影响因素、化学平衡移动和电离平衡常数计算的知识,题目难度较大,考查学生对基础知识的掌握和计算的能力。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| 浓H2SO4△ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:填空题
Ⅰ.恒温,容积为1
L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
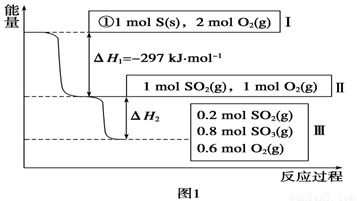
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)
 CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
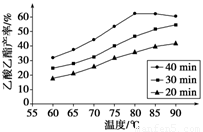
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
(2)已知在一定温度下,C(s)+CO2(g)  2CO(g)平衡常数为K;
2CO(g)平衡常数为K;
①C(s)+H2O(g)  CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;
②CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省、二中高三上学期期末联考化学试卷(解析版) 题型:实验题
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。

(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com