
����Ŀ��һ�������£����Ϊ10 L���ܱ������У�1 mol X��1 mol Y���з�Ӧ��2X(g)��Y(g) ![]() Z(g)(����ӦΪ���ȷ�Ӧ)�÷�Ӧ����60 s�ﵽ��ѧƽ�⣬����0.3 mol Z������˵����ȷ����(����)
Z(g)(����ӦΪ���ȷ�Ӧ)�÷�Ӧ����60 s�ﵽ��ѧƽ�⣬����0.3 mol Z������˵����ȷ����(����)
A. ��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.01 mol��(L��s)��1
B. ��X��Y��Z�����ʱ�Ϊ2:1:1ʱ���ﵽ��ѧƽ��״̬
C. ��Ӧ�ų���������������߷�Ӧ����
D. ��Ӧ�ﵽƽ��ʱ��n(X):n(Y)��1:1
���𰸡�C
��������
A��v(Z)=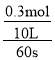 =0.0005mol/(Ls)������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(X)=2v(Z)=2��0.0005mol/(Ls)=0.001mol/(Ls)����A����
=0.0005mol/(Ls)������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(X)=2v(Z)=2��0.0005mol/(Ls)=0.001mol/(Ls)����A����
B. ���ݷ���ʽ���κ�ʱ�̶�����X��Y��Z�����ʱ�Ϊ2:1:1������˵���ﵽ��ѧƽ��״̬����B����
C. ���ŷ�Ӧ�Ľ��У��¶������ߣ���Ӧ���ʻ�ӿ죬��C��ȷ��
D. ���ݷ���ʽ��1 mol X��1 mol Y���з�Ӧ��2X(g)��Y(g) ![]() Z(g)����Ӧ��X��Y��2:1����Ӧ�ﵽƽ��ʱ��n(X):n(Y)һ��������1:1����D����
Z(g)����Ӧ��X��Y��2:1����Ӧ�ﵽƽ��ʱ��n(X):n(Y)һ��������1:1����D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ۻ�ʱ��������H��O����������
B.������Է������������ӣ���±��̼CX4���Ӽ�����������������������Ӧ�ķе�Ҳ������
C.����H��O����H��S���ι̣�����ˮ�ķе��H2S��
D.���ɷ��������ɵ������У����Ӽ�������Խ������Խ�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ�о��绯ѧԭ���������ͼװ�á�����������ȷ���ǣ� ��

A. K��M��N���Ͽ���һ��ʱ���������Һ�������
B. K�ֱ���M��N����ʱ�������ܵ�����
C. K��M����ʱ��ÿת��1mol����Fe��������32gCu
D. K��N����ʱ�� ̼���ϲ���ʹʪ��ĵ��۵⻯����ֽ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�����ֶ����ڵ�����Ԫ�أ������ڱ���λ����ͼ��Xԭ�ӵ��������������������������2��������˵����ȷ���ǣ� ��

A. X�γɵ��⻯��ֻ��һ��
B. ԭ�Ӱ뾶��Y��Z
C. X��Z������������Ӧ��ˮ�����Ϊǿ��
D. X��������ϼ�Ϊ-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�����CO2�Ի�����������Դ���������ش���
��1��Li2O��Na2O��MgO��������CO2�����Ѱ������CO2���������ʣ����н����������____��
a�����ڼ�����������Ѱ��
b��������A����A��Ԫ���γɵ���������Ѱ��
c�����ھ���ǿ�����Ե�������Ѱ��
��2��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500��ʱ��CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700������Ӧ������зų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��____________________________________________��
��3�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��CO2+H2O ![]() CO+H2+O2
CO+H2+O2
��֪��

��ӦA���Ȼ�ѧ����ʽ��___________________________________________________��
��4�����µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�

�� �缫b���� �����������ԭ������Ӧ��
�� CO2�ڵ缫a�ŵ�ķ�Ӧʽ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�͵��������ת�����ۺ����ü������ڽ�Լ��Դ���������ڱ���������
(1)H2��ԭ���Ǵ���ȼú������SO2�ķ���֮һ����֪��
2H2S(g)+SO2(g)��3S(s)+2H2O(l) ��H=a kJ��mol��1
H2S(g)��H2(g)+S(s) ��H=b kJ��mol��1
H2O(l)��H2O(g) ��H=c kJ��mol��1
д��SO2(g)��H2(g)��Ӧ����S(s)��H2O(g)���Ȼ�ѧ����ʽ��____________��
(2)SO2�����������������Ͻ��д���������ȡ���ᣬ����SO2�����������ķ�ӦΪ��2SO2(g)��O2(g)![]() 2SO3(g)������T1�桢0.1 MPa�����£���һ�ܱ�����ͨ��SO2��O2������n(SO2) ��n(O2)��2��1�ݣ������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��
2SO3(g)������T1�桢0.1 MPa�����£���һ�ܱ�����ͨ��SO2��O2������n(SO2) ��n(O2)��2��1�ݣ������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��

��ͼ��A��ʱ��SO2��ת����Ϊ____________��
���������������������£����T2��ʱѹǿ�ı仯������ͼ��ʾ����C�������Ӧ����vc(��)��A����淴Ӧ����vA(��)�Ĵ�С��ϵΪvc(��)______vA(��)�����������������������
��ͼ��B���ѹǿƽ�ⳣ��Kp��_______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
(3)�����ѵ����ɾ�����Ũ��NO������������������ͣ��ʱ���Ϊ90s������£���ò�ͬ������NO���ѵ�����ͼ����ʾ��

����ͼI֪���������е�NO��������ʱ����ѡ��_________������ѵ�Ч�ʡ�
��ͼ���У�ѭ������Һ����Fe2+��Mn2+������ѵ���Ч�ʣ������ԭ��Ϊ____________��
���о�������NaClO2/H2O2���Ը������ռ���ͬʱ��Ч����������ͼ����ʾΪ�������ռ����һ��ʱ���¶ȶ�����������Ӱ�졣
��д�������е�SO2��NaClO2��Ӧ�����ӷ���ʽ��____________________________��
���¶ȸ���60���NOȥ�������¶����߶��½���ԭ��Ϊ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���16��Ԫ�ص�˵������ȷ���ǣ� ��
A.���������+6��
B.�����Ϊ-2��
C.��Ԫ��λ�ڵ�������
D.��Ԫ�����ڢ�A��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO2�������������Ա��Ϊ����ʹ����Դ�������á�
��1����ÿ��ȫ������ȼú8�ڶ֣�ú�к�������������2%�ƣ����������������������_______�ڶ�SO2�ŷŵ�������(����Sȫ��ת��ΪSO2)��
��2������������������SO2����_____(�����)��
a.��ˮ b.����KMnO4��Һ c.��ʯ�� d.Na2CO3��Һ
��3��ij��������(NH4)2SO3��NH4HSO3�Ļ����ҺA���������е�SO2���Ʊ�(NH4)2SO3 ��H2O�������£�

��֪��
�١����ա������У���Һ��(NH4)2SO3��NH4HSO3�����ʵ���֮�ȱ�____(�� ����С������
��(NH4)2SO3��Һ�ʼ��Ե�ԭ����_____��
���ò�ͬ����ҺA����SO2ʱ��SO2�����ʺͷſշ�����NH3���ı仯����ͼ������ͼ�зſշ�����NH3�������ԭ����(NH4)2SO3�����ʵ���֮������_______��

ע����ͬ��ҺA�������ͬ������(NH4)2SO3��NH4HSO3�������ʵ�����ͬ��
�ܡ��Ʊ��������У���ҺB�з����ķ�Ӧ����ʽ��______��
��4�������Ʒ(NH4)2SO3 ��H2O�к�������SO42-�ķ������£�ȡ������Ʒ��ˮ�ܽ⣬_____(��ʵ�������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com