
【题目】常温下,向20mL浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,PH随氨水体积的变化如图。下列说法不正确的是

A. 在B点时:c(H+)=c(OH-)+c(NH3·H2O)
B. 在C点时:c(Cl-)<c(NH4+)+c(NH3·H2O)
C. A点与B点相比:2n(NH4+)A>n(NH4+)B
D. 从C到D的过程中,可能出现:c(Cl-)>c(NH4+)
【答案】D
【解析】A.B点是等浓度、等体积的盐酸和氨水恰好反应生成氯化铵,根据质子守恒,c(H+)=c(OH-)+c(NH3·H2O),A项正确;B.B点是氯化铵溶液,溶液呈酸性,需要加入少量氨水使溶液呈中性,则c(Cl-)<c(NH4+)+c(NH3·H2O),B项正确;C.A点,盐酸反应掉一半,n(NH4+ )=0.01L×0.1000mol/L=0.001mol,B点,盐酸完全反应,n(NH4+ )=0.002mol,A点还存在NH3·H2ONH4+ +OH-,所以2n(NH4+)A>n(NH4+)B,C项正确;D.从C点到D点,溶液呈碱性,c(H+)<c(OH-),根据电荷守恒,c(H+)+c(NH4+ )=c(OH-)+c(Cl-),则c(Cl-)>c(NH4+),D项错误。答案选D。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下有0.1 mol·L-1四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。
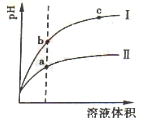
(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )
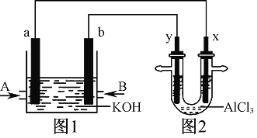
A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-=CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)![]() 2AB3(g)的化学平衡状态的影响如右下图所示(T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g)的化学平衡状态的影响如右下图所示(T表示温度,n表示物质的量)。下列判断正确的是( )

A.反应速率:a>b>c
B.达到平衡时A的转化率大小:b>a>c
C.若T2>T1.则正反应一定是吸热反应
D.达到平衡时,n( AB3)的大小:b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应:
①A+H2O―→B+C ②C + F―→D
③D+NaOH![]() F+E+H2O
F+E+H2O
(1)写出它们的化学式:
C________,D________,E________。
(2)写出各步反应的离子方程式:
①_______________________________________________________________;
③_______________________________________________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O。写出该步反应的化学方程式:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,有关说法中正确的是
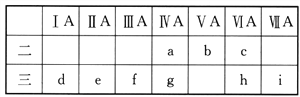
① a、b、e、f四种元素的原子半径:e>f>b>a
② h、i两种元素阴离子的还原性:h>i
③ a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强
A. ①③④ B. ②③⑤ C. ②④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨基酸和蛋白质的认识不正确的是
A. 氨基酸和蛋白质都是两性分子
B. 蛋白质可发生水解,最终得到各种氨基酸
C. 强紫外线灼伤人体皮肤属于皮肤蛋白质的颜色反应
D. 酶是生物体内许多复杂反应的高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______________。
A.每生成1 mol H—Cl键吸收431.4 kJ能量
B. 每生成1 mol H—Cl键放出431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D. 每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是___________。
化学键 | H—H | H—F | H—Cl | H—Br |
键能/kJ/mol | 436 | 565 | 431 | 368 |
A. H2 B. HF C. HCl D. HBr
(3)能用键能大小解释的是____________。
A 常温常压下,溴呈液态,碘呈固态 B.氮气的化学性质比氧气稳定
C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,常温下,4mol HCl被氧化,放出115.6kJ的热量.
写出该反应的热化学方程式_____________________.
(5)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1mol产物的数据)
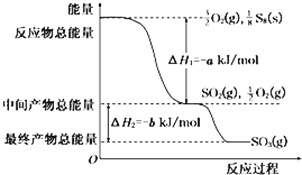
①写出表示S8燃烧热的热化学方程式:______________.
②写出SO3分解生成SO2和O2的热化学方程式:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016课标Ⅲ】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com