
【题目】人类生活、工业生产往往产生大量含碳、氮、硫的废弃气体,合理再利用或转化上述气体,变废为宝成为人们共同关注的课题。
I.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
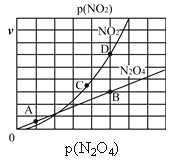
(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
II.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图如图,写出该电池负极的电极反应式_____。
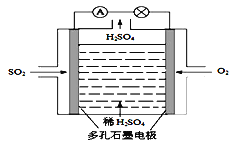
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式_________。

(6)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
【答案】H1+H2 ![]() < BD SO2-2e-+2H2O=SO42-+4H+ HSO3--2e-+H2O=SO42-+3H+ c(Na+)> c(SO32-)=c(HSO3-)>c(OH-)=c(H+)
< BD SO2-2e-+2H2O=SO42-+4H+ HSO3--2e-+H2O=SO42-+3H+ c(Na+)> c(SO32-)=c(HSO3-)>c(OH-)=c(H+)
【解析】
I.(1)根据盖斯定律计算所求反应的焓变,一定温度下,反应达到平衡状态,平衡时v(正)=v(逆),结合速率方程推导反应的化学平衡常数表达式;
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,则反应②就是速控步骤,整个反应化学速率取决于速控步骤的反应,活化能越高,反应速率越慢;
2NO2(g)速率的是反应②,则反应②就是速控步骤,整个反应化学速率取决于速控步骤的反应,活化能越高,反应速率越慢;
(3)反应达到平衡时,存在速率关系为v(正)=v(逆),根据图象和速率表达式分析,解释原因;
II.(4)依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
(5)根据化合价变化判断阳极反应物质,写出阳极反应式。
(6)利用25℃时,H2SO3的电离平衡常数Ka2=1×10-7,可知SO32-的水解常数,从而得知Na2SO3的水解与NaHSO3的电离程度相等。
I.(1)反应2NO(g)+O2(g)![]() 2NO2(g)可由①+②得到,则该反应的焓变为△H=△H1+△H2;
2NO2(g)可由①+②得到,则该反应的焓变为△H=△H1+△H2;
一定温度下,反应达到平衡状态,平衡时v(正)=v(逆),由于2NO(g)+O2(g)![]() 2NO2(g)可由①+②得到,所以该反应的化学平衡常数为K=K1K2,根据速率方程式,K1=
2NO2(g)可由①+②得到,所以该反应的化学平衡常数为K=K1K2,根据速率方程式,K1=![]() ,K2=
,K2=![]() ,则K= K1K2=
,则K= K1K2=![]() ;
;
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,则反应②就是速控步骤,整个反应化学速率取决于速控步骤的反应,反应的活化能越高,反应速率越慢,速控步骤是慢反应,因此化学反应速率①>②,可见②的活化能更高,因此反应①的活化能E1与反应②的活化能E2的大小关系为E1<E2;
2NO2(g)速率的是反应②,则反应②就是速控步骤,整个反应化学速率取决于速控步骤的反应,反应的活化能越高,反应速率越慢,速控步骤是慢反应,因此化学反应速率①>②,可见②的活化能更高,因此反应①的活化能E1与反应②的活化能E2的大小关系为E1<E2;
(3)反应N2O4(g)![]() 2NO2(g)达到平衡时,存在速率关系为v(正)=v(逆),根据反应方程式,应为NO2的消耗速率是N2O4消耗速率的两倍,根据图象,因此能表示该反应达到平衡状态的两个点是B和D;
2NO2(g)达到平衡时,存在速率关系为v(正)=v(逆),根据反应方程式,应为NO2的消耗速率是N2O4消耗速率的两倍,根据图象,因此能表示该反应达到平衡状态的两个点是B和D;
II. (4)该原电池中,负极上二氧化硫失电子被氧化产生硫酸,所以负极上的电极反应式为:SO2-2e-+2H2O=SO42-+4H+;
(5)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3--2e-+H2O=SO42-+3H+;
(6)已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知SO32-的水解常数为Kh=![]() =1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等,则在25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,可知c(SO32-)=c(HSO3-),则溶液中存在c(Na+)> c(S32-)=c(HSO3-)>c(OH-)=c(H+)。
=1×10-7,可知Na2SO3的水解与NaHSO3的电离程度相等,则在25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,可知c(SO32-)=c(HSO3-),则溶液中存在c(Na+)> c(S32-)=c(HSO3-)>c(OH-)=c(H+)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的 NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaC1、CaCl2溶液中溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构如下:![]() ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
A. 所有原子可能在同一平面上B. 最多有5个原子在同一条直线上
C. 所有碳原子可能在同一平面上D. 所有氢原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
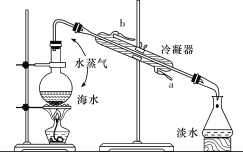
(1)冷却水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步骤③中,反应生成HBr的化学方程式___________________________________________;
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
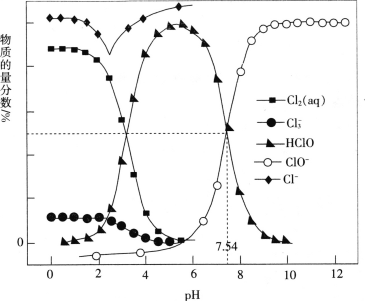
A.pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
B.氯水中的Cl2、ClO-、HClO均能与K2S发生反应
C.已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3- (aq)的K=0.191,当pH增大时,K减小
Cl3- (aq)的K=0.191,当pH增大时,K减小
D.该温度下,HClO![]() H++ClO-的电离常数Ka=10-7.54
H++ClO-的电离常数Ka=10-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列Li原子电子排布图表示的状态中,电离最外层一个电子所需能量最小的是_______(填标号)。
A.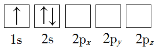 B.
B.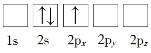
C.![]() D.
D.![]()
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。

(3)下表列有三种物质(晶体)的熔点:
物质 | SiO2 | SiCl4 | SiF4 |
熔点℃ | 1710 | -70.4 | -90.2 |
简要解释熔点产生差异的原因:_______。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子与磷原子最近的距离为_______。用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______g·cm-3。
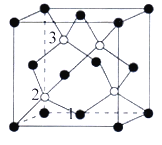
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,0),则原子2和3的坐标分别为_______、______。
,0),则原子2和3的坐标分别为_______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
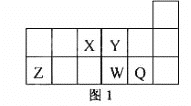
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com