
【题目】海洋约占地球表面积的71%,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
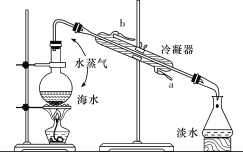
(1)冷却水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步骤③中,反应生成HBr的化学方程式___________________________________________;
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2___________g。
【答案】b 防止暴沸 富集溴 SO2+Br2+2H2O=H2SO4+2HBr 320
【解析】
Ⅰ. (1)海水淡化时所用的冷凝管,进出水方向是“下进上出”;
(2) 在海水中加碎瓷片是为了防止暴沸;
Ⅱ. (1)根据②③步发生的反应可知,是为了将海水中的溴离子转化为溴单质吹出富集溴;
(2)第③步的反应是溴和水蒸气、二氧化硫发生了氧化还原反应生成了溴化氢和硫酸;
(3)根据溴离子与氯气发生反应的离子方程式计算通入44.8 L Cl2(标准状况),理论上可得Br2的质量。
(1)海水淡化过程中冷凝管的进出水方向是“下进上出”,所以b是出水口,
故答案为:b;
(2)在加热海水的过程中加入碎瓷片是为防止暴沸,
故答案为:防止暴沸;
(3)从海水中提取溴,是将溴离子转化为溴单质吹出,所以②③步操作的目的是富集溴,
故答案为:富集溴;
(4)溴、水蒸气、二氧化硫反应生成的是溴化氢和硫酸,化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(5)第②步的反应是2Br-+Cl2=Br2+2Cl-,标准状况下44.8 L Cl2是2mol,可得到Br2是2mol,m(Br2)=n·M=2mol×160g/mol=320g,
故答案为:320。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
【题目】氢、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式__________________
(2)和铜在同一周期中,基态原子未成对电子数为2的元素共有______种。
(3)NH4HF2中HF2-的结构为F-H.......F-,则NH4HF2中含有的化学键有_________
(A)离子键 (B)共价键 (C)金属键 (D)氢键 (E)配位键
(4)写出与NH4+互为等电子体的一种分子的化学式________;
(5)CH3OH分子中C原子的杂化方式为_________,键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
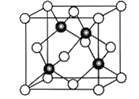
(6)Cu与Cl形成某种化合物的晶胞如下图所示,Cu的配位数是________,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为____________(用含ρ、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)
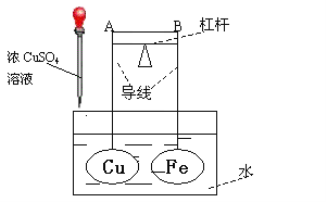
A.杠杆为导体或绝缘体时,均为A端低B端高
B.杠杆为导体A端高B端低;杠杆为绝缘体时,AB保持水平
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
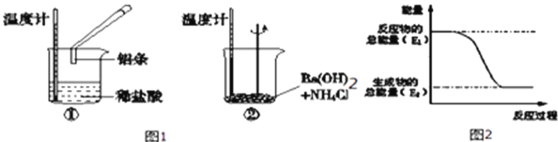
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,据实验现象判断①是_________热反应,②是_________热反应.反应过程___(填“①”或“②”)的能量变化可用图2表示.
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号).
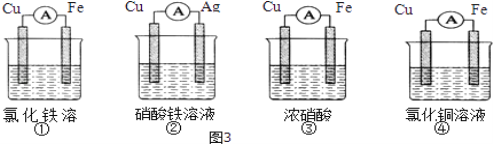
(3)将H2设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒),负极通入_______其电极反应式为________________电池总反应为______________
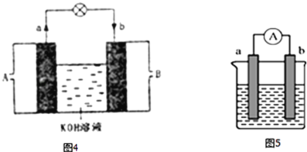

(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
①若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式___________;若电极保持不变,将电解质溶液换成硫酸铜,请将该电池设计为双液原电池画入图6中___________;
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠时,该原电池的负极为_______;该原电池的电池总反应为_____________________________.
③若电池的总反应是2FeCl3+Fe![]() 3FeCl2,则可以作正极材料的是________,正极反应式是__________若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_____。
3FeCl2,则可以作正极材料的是________,正极反应式是__________若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
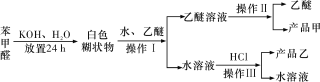
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活、工业生产往往产生大量含碳、氮、硫的废弃气体,合理再利用或转化上述气体,变废为宝成为人们共同关注的课题。
I.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
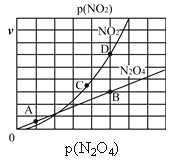
(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
II.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图如图,写出该电池负极的电极反应式_____。
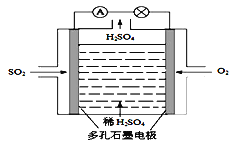
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式_________。

(6)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________________________。
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_______________。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:①_____________________________________;
_____________________________________。
(4)D、A按原子个数比3∶2形成化合物丙的化学式为____________。
(5)C、B可按原子个数比1∶1形成化合物乙的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置(夹持与加热仪器省略)进行实验,将A中浓硫酸逐滴加入B中(放有木炭),回答下列问题:

(1)图中C装置在实验中的作用是____________。
(2)木炭与浓硫酸反应的化学方程式为____________。
(3)产生的气体通往D中,下列有关实验现象或结论正确的是____________。
A.若D中放有足量的BaCl2溶液,可以产生两种白色沉淀
B.若D中放有足量的Ca(OH)2溶液,可以产生两种白色沉淀
C.若D中放有少量的KMnO4溶液,一段时间后溶液褪色,可证明木炭与浓硫酸反应,有漂白性气体生成
D.若D中放有少量紫色石蕊溶液,一段时间后,溶液先变红色后褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com