
【题目】我国科研人员以Zn和尖晶石型锰酸锌( ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1)。下列说法正确的是( )
ZnMn2O4(0<x<1)。下列说法正确的是( )
A.放电时,Zn2+向负极迁移
B.充、放电过程中,仅锌元素的价态发生变化
C.充电时,阳极的电极反应式为ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+
D.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20 g (已知F =96500 C/mol)
【答案】C
【解析】
根据电池的电池反应式为:xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1),可知,放电时,Zn的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Zn-2e-=Zn2+;正极反应为:Zn1-xMn2O4+xZn2++2xe-═ZnMn2O4,充电时阴阳极反应与负极、正极反应刚好相反,充电时,电解池阳离子向阴极移动,据此分析解答。
ZnMn2O4(0<x<1),可知,放电时,Zn的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Zn-2e-=Zn2+;正极反应为:Zn1-xMn2O4+xZn2++2xe-═ZnMn2O4,充电时阴阳极反应与负极、正极反应刚好相反,充电时,电解池阳离子向阴极移动,据此分析解答。
A.放电时,Zn2+向负电荷较多的正极迁移,A错误;
B.充放电过程中锰元素的化合价也变化,所以充放电过程中锌与锰的化合价变化,B错误;
C.充电时阳极发生氧化反应,与正极反应刚好相反,所以阳极的电极反应为:ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+,C正确;
D.若维持电流强度为0.5A,放电10分钟,转移电量Q=0.5×10×60C=300C,假设反应消耗Zn质量为x,则![]() =300,解得x=0.1g,D错误;
=300,解得x=0.1g,D错误;
故合理选项是C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,装置如图所示。下列说法错误的是( )
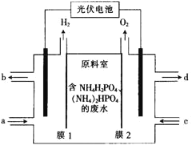
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.每放出11.2L(标准状况)H2时,能回收98gH3PO4
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.a处进入稀氨水,d处流出浓H3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
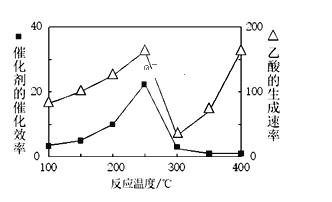
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用印刷电路板的废腐蚀液(含CuCl2、FeCl2 和FeCl3)回收制备CuCl22H2O和Fe2O3,的过程如下,下列说法错误的是( )
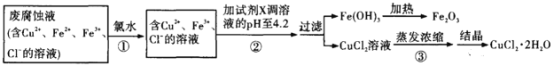
A.步骤①加入氯水的目的是将Fe2+转化成Fe3+
B.步骤②加入的试剂X可为铜粉
C.步骤③蒸发浓缩时滴加浓盐酸,目的是抑制CuCl2水解
D.Fe2O3可用作红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含Fe2O3、FeO、SiO2、Al2O3的混合物为原料,设计两种制备铁红(Fe2O3)的方案,部分产物已略去。
(方案1 )
![]()
(方案2 )
![]()
(1)溶液A所含阳离子有_________________
(2)加入双氧水的作用是_________________
(3)固体C 的成分是_________________(填化学式)
(4)试剂x可以选择_________________(填序号)
a.NaOH溶液 b.氨水 c.二氧化碳 d.稀硫酸
(5)用试剂x浸取原料发生的离子方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
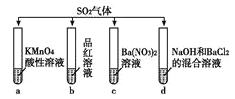
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com