
【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率
【答案】0.00417mol·L-1·min-1 4:5 1.488 < > BD
【解析】
(1)根据化学反应速率公式计算可得;
(2)建立三段式,依据三段式计算可得;
(3)建立三段式,依据三段式计算可得;
(4)温度越高,反应速率越快,达到平衡所需反应时间越少;
(5)A、当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应可能达到平衡,也可能未达到平衡;
B、由质量守恒定律可知,反应前后气体质量不变,恒容容器中气体体积不变,容器中气体密度始终不变;
C、将HCOOH液化后分离,生成物浓度减小,化学反应速率减小;
D、选用更高效的催化剂,可加快反应速率,缩短达到平衡所需时间。
(1)由题给表格可知,实验I中0~60min内氢气的物质的量变化量为(2.00—1.50)mol=0.50mol,由方程式可知甲酸的物质的量变化量为0.50mol,则0~60min内用甲酸表示的该反应的平均反应速率为![]() =0.00417 mol·L-1·min-1,故答案为:0.00417 mol·L-1·min-1;
=0.00417 mol·L-1·min-1,故答案为:0.00417 mol·L-1·min-1;
(2)由题意建立如下三段式:
CO2(g)+H2(g) ![]() HCOOH(g)
HCOOH(g)
起(mol) 2 2 0
变(mol) 0.8 0.8 0.8
末(mol) 1.2 1.2 0.8
由P1:P0=n1:n0可得P1:P0=3.2mol:4mol=4:5,故答案为:4:5;
(3)由表格数据可知,T2温度下120min时反应达到平衡,由此建立三段式如下
CO2(g)+H2(g) ![]() HCOOH(g)
HCOOH(g)
起(mol/L) 1 1 0
变(mol/L) 0.45 0.45 0.45
平(mol/L) 0.55 0.55 0.45
则化学平衡常数K=![]() =1.488,故答案为:1.488;
=1.488,故答案为:1.488;
(4)温度越高,反应速率越快,达到平衡所需反应时间越少,由题给表格数据可知,T2温度下120min时反应达到平衡,T1温度下150min时反应达到平衡,则T1小于T2;温度越高,氢气的物质的量越小,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,△H >0,故答案为:<;>;
(5)A、当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应可能达到平衡,也可能未达到平衡,故错误;
B、由质量守恒定律可知,反应前后气体质量不变,恒容容器中气体体积不变,容器中气体密度始终不变,则容器中气体密度不再改变,不能判断该反应是否达到平衡,故正确;
C、将HCOOH液化后分离,生成物浓度减小,化学反应速率减小,故错误;
D、选用更高效的催化剂,可加快反应速率,缩短达到平衡所需时间,提高生产效率,故正确;
BD正确,故答案为:BD。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌( ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1)。下列说法正确的是( )
ZnMn2O4(0<x<1)。下列说法正确的是( )
A.放电时,Zn2+向负极迁移
B.充、放电过程中,仅锌元素的价态发生变化
C.充电时,阳极的电极反应式为ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+
D.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20 g (已知F =96500 C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的电子排布式为______。
(2)FeSO4常作净水剂和补铁剂,SO42-的立体构型是______。
(3)羰基铁[Fe(CO)5]可作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含______molσ键。
(4)氮化铁晶体的晶胞结构如图1所示(Fe3+离子为六方最密堆积)。该晶体中铁、氮的微粒个数之比为______。在该晶胞中,与Fe3+紧邻且等距离的Fe3+数目为______。
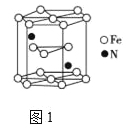
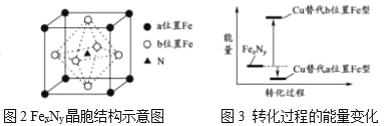
(5)某铁氮化合物(FexNy)的晶胞如图2所示,N原子位于b位置Fe形成的空隙,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图3所示,其中更稳定的Cu替代型产物的化学式为______。
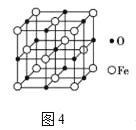
(6)氧化亚铁晶体的晶胞如图4所示。已知:氧化亚铁晶体的密度为ρg/cm3,NA代表阿伏伽德罗常数的值,Fe2+与O2-最短核间距为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废旧锂离子电池的正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,其流程如图所示:下列叙述错误的是

A. 在空气中灼烧可除去MnO2中的碳粉
B. 反应②中LiMn2O4是还原剂
C. 反应①可用氨水代替NaOH溶液
D. 从正极材料中可回收的金属元素有Mn、Li、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
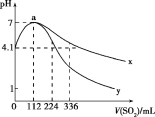
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com