
【题目】从某废旧锂离子电池的正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,其流程如图所示:下列叙述错误的是

A. 在空气中灼烧可除去MnO2中的碳粉
B. 反应②中LiMn2O4是还原剂
C. 反应①可用氨水代替NaOH溶液
D. 从正极材料中可回收的金属元素有Mn、Li、Al
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
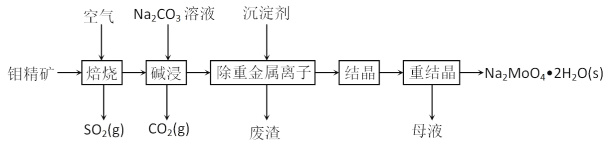
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为____________________,氧化产物是__________________
(3)“碱浸”时生成CO2的电子式为______________,碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________________。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.硫酸氢钠溶液与碳酸氢钠溶液混合:HSO4-+HCO3-=H2O+CO2↑+SO42-
B.烧碱溶液与醋酸溶液混合:OH-+H+ =H2O
C.铁单质与氯化铁溶液生成氯化亚铁:Fe3++Fe=2Fe2+
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ +3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
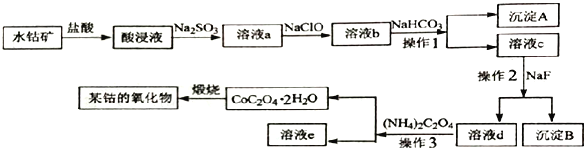
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________。
(3)溶液a中加入NaClO的作用为_______________________________。
(4)沉淀A 的成分为__________________。操作2的名称是___________________。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5moI/L,此时溶液中c(Ca2+)最大等于_________mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体。S2Cl2是一种有毒并有恶臭气味的浅黄色液体,在300℃以上完全分解,其蒸汽遇水分解,易溶解硫磺;将适量氯气通入熔融的硫磺而得,过量的Cl2会将S2Cl2进一步氧化得到SCl2。以下是对S2Cl2的制备及研究,请回答下列问题:
Ⅰ.S2Cl2的制备
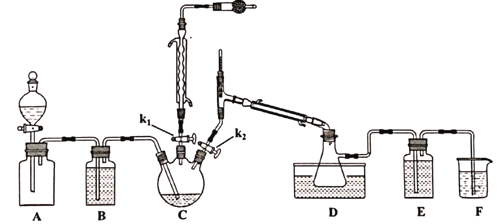
已知,各物质的熔沸点如下:
物质 | S | S2Cl2 | SCl2 |
沸点/℃ | 445 | 138 | 59 |
熔点/℃ | 113 | -76 | -122 |
制备的流程为:
①A装置集气瓶中充满Cl2,打开A装置中的分液漏斗,打开k1、k2,一段时间后关闭k2。
②接通冷凝水,将C加热至135~140℃。
③一段时间后关闭k1,同时打开k2,最后在D中收集到浅黄色液体。
(1)实验室制取氯气的反应方程式_________________________________。
(2)A装置分液漏斗中盛装的液体是___________。
A.CCl4 B.饱和NaHCO3溶液 C饱和NaCl溶液
(3)滴加过程要缓慢,原因是____________________________________________。
(4)D装置中水浴温度应控制为___________,原因是_______________________________。
Ⅱ.S2Cl2纯度的测定
已知:S2Cl2遇水分解的化学方程式:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,取agⅡ中黄色液体于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的C0 mol/L的AgNO3溶液V0mL。再向锥形瓶中加入硝基苯,将生成的沉淀覆盖。加入适量Fe(NO3)3作指示剂,用C1 mol/L NaSCN溶液滴定至终点,消耗 NaSCN溶液V1mL(滴定过程发生反应:Ag++SCN-= AgSCN↓)
(5)滴定终点的现象为_________________________________。
(6)S2Cl2的纯度为___________(写出表达式);若滴定过程中未加硝基苯,则所得纯度___________。(填“偏大”、“偏小”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分B、C、D、E、F 是原子序数依次增大的短周期主族元素,B 是短周期中金属性最强的 元素,C 是同周期中离子半径最小的元素,D 元素的最高价氧化物对应水化物与 B 元素的最高 价氧化物对应水化物反应的产物 M 是制备木材防火剂的原料,E 的最外层电子数与内层电子数 之比为 3﹕5。请回答:
(1)D 的原子结构示意图为___________________。
(2)写出工业制 F 单质的化学方程式:___________________。
(3)用电子式表示元素 B 与元素 F 形成的化合物:___________________。
(4)B单质与氧气反 应的产物与 C 的单质同时放入水中,产生两种无色气体,有关的化学方程式为____________________、___________________。
(5)写出 M 与盐酸反应的离子方程式:___________________。
(6)工业上将干燥的 F 单质通入熔融的 E 单质中可制得化合物 E2F2,该物质可与水反应生成 一种能使品红溶液褪色的气体,0.2mol 该物质参加反应时转移 0.3mol 电子,其中只有一种元素化合价发生改变,该反应的化学方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com