
����Ŀ�����Ȼ�����(S2C12)�����л�������Ʒ��ɱ�������Ⱦ�ϡ��ϳ��������е��Ȼ������м��塣S2Cl2��һ���ж����ж����ζ��dz��ɫҺ�壬��300��������ȫ�ֽ⣬��������ˮ�ֽ⣬���ܽ���ǣ�����������ͨ�����ڵ���Ƕ��ã�������Cl2�ὫS2Cl2��һ�������õ�SCl2�������Ƕ�S2Cl2���Ʊ����о�����ش��������⣺
��.S2Cl2���Ʊ�
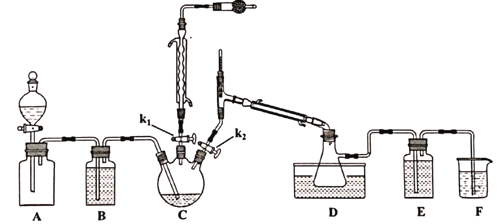
��֪�������ʵ��۷е����£�
���� | S | S2Cl2 | SCl2 |
�е�/�� | 445 | 138 | 59 |
�۵�/�� | 113 | ��76 | ��122 |
�Ʊ�������Ϊ��
��Aװ�ü���ƿ�г���Cl2����Aװ���еķ�Һ©������k1��k2��һ��ʱ���ر�k2��
�ڽ�ͨ����ˮ����C������135~140�档
��һ��ʱ���ر�k1��ͬʱ��k2�������D���ռ���dz��ɫҺ�塣
(1)ʵ������ȡ�����ķ�Ӧ����ʽ_________________________________��
(2)Aװ�÷�Һ©����ʢװ��Һ����___________��
A.CCl4 B.����NaHCO3��Һ C����NaCl��Һ
(3)�μӹ���Ҫ������ԭ����____________________________________________��
(4)Dװ����ˮԡ�¶�Ӧ����Ϊ___________��ԭ����_______________________________��
��.S2Cl2���ȵIJⶨ
��֪��S2Cl2��ˮ�ֽ�Ļ�ѧ����ʽ��2S2Cl2+2H2O=3S��+SO2��+4HCl��ȡag���л�ɫҺ������ƿ����ˮ����Ӧ��ȫ(�������ʾ�����ˮ��Ӧ)��������Һ�м��������C0 mol/L��AgNO3��ҺV0mL��������ƿ�м����������������ɵij������ǡ���������Fe��NO3)3��ָʾ������C1 mol/L NaSCN��Һ�ζ����յ㣬���� NaSCN��ҺV1mL(�ζ����̷�����Ӧ��Ag++SCN-= AgSCN��)
(5)�ζ��յ������Ϊ_________________________________��
(6)S2Cl2�Ĵ���Ϊ___________(д������ʽ)�����ζ�������δ���������������ô���___________��(�ƫ����ƫС��������Ӱ�족)
���𰸡�Mn02+4HCl![]() MnCl2+Cl2��+2H20 C ����Cl2���٣�ʹCl2��S��ֽӴ�����ֹ����SCl2 ����59��C �������ɵ�S2Cl2��SCl2 ���һ��NaSCN���£���Һ��Ϊdz��ɫ����30s����ȥ
MnCl2+Cl2��+2H20 C ����Cl2���٣�ʹCl2��S��ֽӴ�����ֹ����SCl2 ����59��C �������ɵ�S2Cl2��SCl2 ���һ��NaSCN���£���Һ��Ϊdz��ɫ����30s����ȥ ![]() ƫС
ƫС
��������
I.��1��ʵ������ͨ���ö������̺�Ũ���Ṳ����ȡ������
��2������������ˮ��Ϊ�˽���������ˮ�е��ܽ�ȣ���˳��ʹ������������װ��A��ʢװ��Һ��Ϊ����ʳ��ˮ��
��3���μӹ���Ҫ�����������ٹ��������������������������ὫS2Cl2��һ�������õ�SCl2��
��4��Ϊ��ʹ���ɵ�S2Cl2��SCl2���룬���Ƶ��¶�Ӧ����SCl2�ķе㣻
II. ��5��NaSCN��Һ��Ŀ��Ϊ�ⶨ��Һ��δ���뷴Ӧ�������ӵ����ʵ�����������һ��NaSCN��Һʱ����Һ�е�������ǡ��������ϣ���Fe3++3SCN-= Fe��SCN��3��Fe��SCN��3ΪѪ��ɫ��
��6����������SCN-��Cl-��Ӧ�������ӵ���Դ��S2Cl2��������Ԫ���غ㼴�ɵõ��𰸣�
I.��1��ʵ������ͨ���ö������̺�Ũ���Ṳ����ȡ��������Ӧ����ʽΪ��Mn02+4HCl![]() MnCl2+Cl2��+2H20��
MnCl2+Cl2��+2H20��
��2������������ˮ��Ϊ�˽���������ˮ�е��ܽ�ȣ���˳��ʹ������������װ��A��ʢװ��Һ��Ϊ����ʳ��ˮ����ΪC��
��3���μӹ���Ҫ�����������ٹ��������������������������ὫS2Cl2��һ�������õ�SCl2����Ϊ������Cl2���٣�ʹCl2��S��ֽӴ�����ֹ����SCl2��
��4��Ϊ��ʹ���ɵ�S2Cl2��SCl2���룬���Ƶ��¶�Ӧ����SCl2�ķе㣬��Ϊ������59��C���������ɵ�S2Cl2��SCl2��
II. ��5��NaSCN��Һ��Ŀ��Ϊ�ⶨ��Һ��δ���뷴Ӧ�������ӵ����ʵ�����������һ��NaSCN��Һʱ����Һ�е�������ǡ��������ϣ���Fe3++3SCN-= Fe��SCN��3��Fe��SCN��3ΪѪ��ɫ����Ϊ�����һ��NaSCN���£���Һ��Ϊdz��ɫ����30s����ȥ��
��6����������SCN-��Cl-��Ӧ�������ӵ���Դ��S2Cl2��������Ԫ���غ㼴�ɵõ��𰸣�������n��Ag+��=C0 mol/L��V0mL����NaSCN��Ӧ��n��Ag+��=C1 mol/L��V1mL�����������ӷ�Ӧ��n��Ag+��= C0 mol/L��V0mL- C1 mol/L��V1mL��n��S2Cl2��=![]() n��Cl-��=
n��Cl-��= ![]() ��C0 mol/L��V0mL- C1 mol/L��V1mL������=
��C0 mol/L��V0mL- C1 mol/L��V1mL������=![]() �����ζ�������δ��������������AgCl��s��Ag+��aq��+Cl-��aq����������NaSCN��Һ��Ӧ�����������ʵ���ƫ�ߣ��������ӷ�Ӧ�����������ʵ���ƫ�ͣ�����ƫ�ͣ�
�����ζ�������δ��������������AgCl��s��Ag+��aq��+Cl-��aq����������NaSCN��Һ��Ӧ�����������ʵ���ƫ�ߣ��������ӷ�Ӧ�����������ʵ���ƫ�ͣ�����ƫ�ͣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�к���Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32-��SO32-��S![]() ��Cl-��N
��Cl-��N![]() ���е�һ�ֻ���,ȡ����Һ��������ʵ��,ʵ���������:(��֪����D�ڳ��³�ѹ�³ʺ���ɫ)
���е�һ�ֻ���,ȡ����Һ��������ʵ��,ʵ���������:(��֪����D�ڳ��³�ѹ�³ʺ���ɫ)

��1������������,��ҺX�г�H+��϶������е�������_,һ��������������__������ȷ���Ƿ��е�������_______���������������ӵķ�����________��
��2������G�Ļ�ѧʽΪ______��
��3��д������A�����ӷ���ʽ:________��
��4��д����ҺH��ͨ�����CO2�����ӷ���ʽ:________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�Ͼ�����ӵ�ص��������ϣ�LiMn2O4��̼�۵�Ϳ���������ϣ��л��ս�����Դ����������ͼ��ʾ�����������������

A. �ڿ��������տɳ�ȥMnO2�е�̼��
B. ��Ӧ����LiMn2O4�ǻ�ԭ��
C. ��Ӧ�ٿ��ð�ˮ����NaOH��Һ
D. �����������пɻ��յĽ���Ԫ����Mn��Li��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������һƿ��84����Һ������װ˵�����£�

����������Ϣ�����֪ʶ�жϣ����з�������ȷ����
A.�á�84����Һ�������ʵ���Ũ��ԼΪ4.0mol��L-1
B.һƿ�á�84����Һ�������տ�����44.8L��CO2(��״��)����ȫ����
C.ȡ100mL�á�84����Һ��ϡ��100��������������ϡ�ͺ����Һ��c(Na��)ԼΪ0.04mol��L-1
D.���ĸá�84����Һ�����䷽������NaClO��������480mL��25% NaClO������Һ����Ҫ������NaClO��������Ϊ149g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������Ķ���������Ԫ�ء�Y��Zͬ���������ڣ�X��Wͬ������X��Y���ڲ�ͬ���ڣ�Y��Zԭ�ӵĵ������ܺ���X��Wԭ�ӵĵ������ܺ�֮��Ϊ5��4������˵����ȷ����
A. ԭ�Ӱ뾶��r(W)��r(Z)��r(Y)��r(X)
B. Y�ļ���̬�⻯������ȶ��Ա�Z��ǿ
C. ��Z��W��ɵĻ�����ֻ��һ��
D. ��X��Y��Z����Ԫ����ɵĻ�����������ᡢ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ŷŵ���ˮ�к���FeSO4��CuSO4�������ʡ��ס��ҡ�����λѧ���ֱ�����˴Ӹ���ˮ�л��մ�������ͭ�ķ�������ͼ��ʾ)��
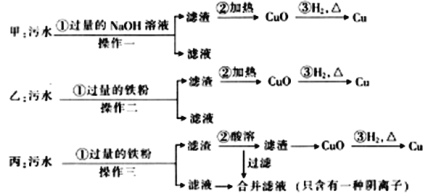
��1���ס��ҡ��������ʵ�鷽���ܷ�õ������Ľ���ͭ��
��___����___����___������ܡ����ܡ�)
��2���ڱ�ͬѧ���еġ����ܡ������У����������___(�ϡ���ᡱ��ϡ���ᡰ)���ϲ�����Һ�е���Ҫ������___��
��3����ͬѧ�ķ����У����̢ټ������������ʱ������Ӧ�Ļ�ѧ����ʽΪ___��
��4������һ����������������___���ò�������ʹ�õIJ���������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�����������˵����ȷ���ǣ�������
A. ��״���£�11.2L�ļ��������ķ�����Ϊ0.5NA
B. 28g��ϩ�������õ��Ӷ���ĿΪ4NA
C. 1mol�ǻ�����������Ϊ7 NA
D. ������ϩ����ϩ�Ļ�����干14g����ԭ����Ϊ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ����FeCl3��Һ | ��FeCl3�����ܽ�����������ˮ |
B | ��ȡ2.0gNaOH ���� | ���������ϸ���һ����ֽ��Ȼ��������������2g ���룬����������NaOH ���� |
C | ������Һ���Ƿ���NH4+ | ȡ������Һ���Թ��У�����NaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ������������� |
D | ��֤����������ʴ | �����������Թ��У��������û |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ı�����ȷ����(�� ��)
A. NH4++H2O��NH3��H2O+H��
B. Na2SO3+2H2O![]() 2NaOH+2H2SO3
2NaOH+2H2SO3
C. NaHCO3��Na++H++CO32-
D. BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com