
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
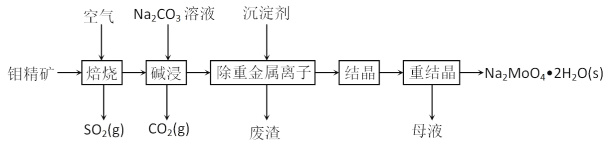
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为____________________,氧化产物是__________________
(3)“碱浸”时生成CO2的电子式为______________,碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________________。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为____________________________________________________________。
【答案】粉碎固体 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2
2MoO3+4SO2 MoO3、SO2 ![]() MoO3+CO32-=MoO42-+CO2
MoO3+CO32-=MoO42-+CO2![]() PbS MoS2+6NO3-=MoO42+2SO42+6NO
PbS MoS2+6NO3-=MoO42+2SO42+6NO![]()
【解析】
(1)提高焙烧效率的方法有:将钼精矿粉碎、可增加反应接触面积、提高焙烧效率,
故答案为:粉碎固体;
(2)“焙烧”时MoS2转化为MoO3,同时生成SO2,结合电子守恒和原子守恒可得发生反应的化学方程式2MoS2+7O2![]() 2MoO3+4SO2;该反应中Mo和S元素化合价都升高,氧化产物是MoO3和SO2;
2MoO3+4SO2;该反应中Mo和S元素化合价都升高,氧化产物是MoO3和SO2;
答案为:2MoS2+7O2![]() 2MoO3+4SO2;MoO3、SO2;
2MoO3+4SO2;MoO3、SO2;
(3)CO2的电子式为![]() ;“碱浸”时MoO3和Na2CO3反应生成CO2和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,离子反应方程式:MoO3+CO32-=MoO42-+CO2
;“碱浸”时MoO3和Na2CO3反应生成CO2和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,离子反应方程式:MoO3+CO32-=MoO42-+CO2![]() ;
;
答案为:MoO3+CO32-=MoO42-+CO2![]()
(4)由钼精矿含有少量的杂质为PbS可知,除重金属离子就是出去溶液中的Pb2+,因此废渣为PbS;
故答案为:PbS;
(5)硝酸作氧化剂,将MoS2氧化成MoO42和SO42,用NaNO3在酸性条件下氧化MoS2,发生反应的离子方程式为:MoS2+6NO3-=MoO42+2SO42+6NO![]() ;
;
答案为:MoS2+6NO3-=MoO42+2SO42+6NO![]() ;
;


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C.将体积增大为原来的2倍,再次达到平衡时,气体的密度变小
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个N2,含分子数最多的是______(填序号,下同),含电子数最多的是________,质量最大的是______,体积最小的是______;密度由小到大的顺序为________________。
(2)0.5mol某固体A的质量是40g,A的摩尔质量为_________。
(3)质量之比为8∶7的两种气体O2、CO,其分子数之比为_______________;氧原子数之比为____________;相同条件下的体积之比为________。
(4) 4.8g碳在一定量的氧气中燃烧,反应后生成CO和CO2的总质量为12.8g。则在同温同压下,生成的CO和CO2的体积比为__________。
(5)由NaHS,MgSO4,NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、S![]() 、Cl-、N
、Cl-、N![]() 。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)
。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)

(1)上述离子中,溶液X中除H+外肯定还含有的离子是_,一定不含的离子是__,不能确定是否含有的离子是_______,检验其中阳离子的方法是________。
(2)沉淀G的化学式为______。
(3)写出生成A的离子方程式:________。
(4)写出溶液H中通入过量CO2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
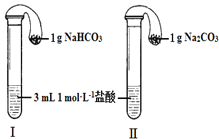
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某校化学小组学生利用如图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
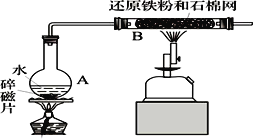
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_____________________________。装置B中发生反应的化学方程式是________________________________。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法____________________________________。
Ⅱ、利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
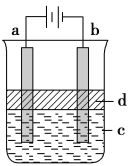
(1)a电极的材料应为__________,电极反应式为__________________。
(2)d为苯,其作用是________________。
(3)当电解一段时间后看到白色Fe(OH)2沉淀,然后向溶液中通入空气,可观察的现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废旧锂离子电池的正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,其流程如图所示:下列叙述错误的是

A. 在空气中灼烧可除去MnO2中的碳粉
B. 反应②中LiMn2O4是还原剂
C. 反应①可用氨水代替NaOH溶液
D. 从正极材料中可回收的金属元素有Mn、Li、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com