
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
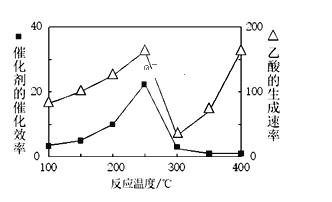
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
【答案】64mol2L-2 △H1-2△H3+2△H2 温度在250~300℃时,催化剂的催化效率降低 增大反应压强、增大CO2的浓度 Cu 2 ac CO2+Li4SiO4![]() Li2CO3+Li2SiO3
Li2CO3+Li2SiO3
【解析】
(1) ①根据K=![]() 计算;
计算;
②根据盖斯定律计算;
(2)①催化剂的活性降低,导致温度升高而乙酸的生成速率降低;
②根据方程式,增大压强,或增大CO2的浓度,可使平衡正向进行;
③被还原HNO3为化合价降低的硝酸;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质;
b.Li2O、Na2O、MgO都没有强氧化性,则吸收二氧化碳与氧化还原无关;
c.Li2O、Na2O、MgO均能吸收CO2,锂、钠、镁为ⅠA、ⅡA族元素,可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3。
(1) ①K=![]() =
=![]() =64mol2L-2;
=64mol2L-2;
②①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1,②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1,③2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1,根据盖斯定律,①+2×②-2×③,即可得到CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g),则ΔH=△H1-2△H3+2△H2 kJmol-1;
2CO(g)+2H2(g),则ΔH=△H1-2△H3+2△H2 kJmol-1;
(2)①催化剂的活性降低,导致温度升高而乙酸的生成速率降低;
②根据方程式,增大压强,可使平衡正向进行,或增大CO2的浓度,也可使平衡正向进行,从而提高CH4的转化率。
③Cu2Al2O4中Cu的化合价为+1价,与硝酸反应时,变为+2价,被氧化;每消耗3molCu2Al2O4时,转移6mol电子,则硝酸的化合价由+5变为+2价,被还原HNO3为2mol;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,符合题意,a正确;
b.Li2O、Na2O、MgO都没有强氧化性,则吸收二氧化碳与氧化还原无关,与题意不符,b错误;
c.Li2O、Na2O、MgO均能吸收CO2,锂、钠、镁为ⅠA、ⅡA族元素,可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,符合题意,c正确;
答案为ac;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,则方程式为CO2+Li4SiO4![]() Li2CO3+Li2SiO3。
Li2CO3+Li2SiO3。


科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图乙所示。

则下列结论正确的是(双选) ( )。
A.该反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.若其他条件不变,升高温度,平衡将向逆反应方向移动
C.若其他条件不变,开始时将该容器压缩为1 L,则反应将按图丙进行
D.若其他条件不变,使用适当的催化剂,则反应可以按图丙进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述错误的是( )
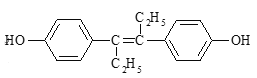
A.乙烯雌酚能发生取代、加成、氧化反应
B.乙烯雌酚可分别与NaOH、NaHCO3溶液反应
C.每1mol该有机物最多可以与含5molBr2的溴水反应
D.该有机物分子中最多有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌( ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1)。下列说法正确的是( )
ZnMn2O4(0<x<1)。下列说法正确的是( )
A.放电时,Zn2+向负极迁移
B.充、放电过程中,仅锌元素的价态发生变化
C.充电时,阳极的电极反应式为ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+
D.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20 g (已知F =96500 C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废旧锂离子电池的正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,其流程如图所示:下列叙述错误的是

A. 在空气中灼烧可除去MnO2中的碳粉
B. 反应②中LiMn2O4是还原剂
C. 反应①可用氨水代替NaOH溶液
D. 从正极材料中可回收的金属元素有Mn、Li、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com