
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述错误的是( )
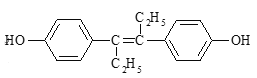
A.乙烯雌酚能发生取代、加成、氧化反应
B.乙烯雌酚可分别与NaOH、NaHCO3溶液反应
C.每1mol该有机物最多可以与含5molBr2的溴水反应
D.该有机物分子中最多有18个碳原子共平面
科目:高中化学 来源: 题型:
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。

①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______。
(2)写出A分别与B、C、D所形成化合物的化学式:_________、_________、_________。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于那类物质?__________写出它们相互反应的化学方程式。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
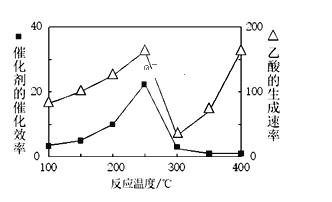
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
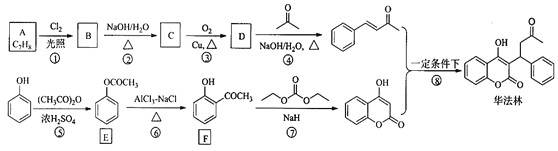
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用印刷电路板的废腐蚀液(含CuCl2、FeCl2 和FeCl3)回收制备CuCl22H2O和Fe2O3,的过程如下,下列说法错误的是( )
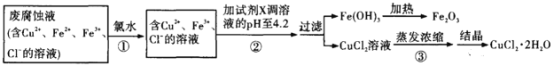
A.步骤①加入氯水的目的是将Fe2+转化成Fe3+
B.步骤②加入的试剂X可为铜粉
C.步骤③蒸发浓缩时滴加浓盐酸,目的是抑制CuCl2水解
D.Fe2O3可用作红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
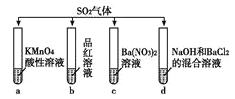
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
A. 反应①和②均为氧化还原反应
B. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应①中每生成1 mol Na2CrO4时转移电子3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com