
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
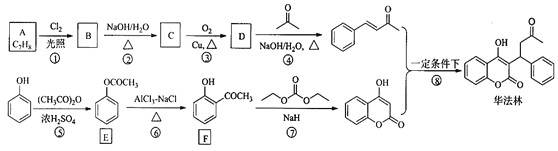
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
【答案】甲苯 酯基 ![]()
![]() 取代反应 加成反应 13
取代反应 加成反应 13 ![]()
【解析】
由A的分子式及产物的性质,可确定A为![]() ,在光照条件下发生-CH3上的取代反应生成B(
,在光照条件下发生-CH3上的取代反应生成B(![]() ),B发生水解反应生成C(
),B发生水解反应生成C(![]() ),C催化氧化生成D(
),C催化氧化生成D(![]() ),D与CH3COCH3在NaOH、加热条件下发生羟醛缩合反应,生成
),D与CH3COCH3在NaOH、加热条件下发生羟醛缩合反应,生成![]() 和水。
和水。
(1)A为![]() ,名称为甲苯,E为
,名称为甲苯,E为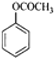 ,官能团名称为酯基。答案为:甲苯;酯基;
,官能团名称为酯基。答案为:甲苯;酯基;
(2)由以上分析知,B 的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(3)C(![]() )催化氧化生成D(
)催化氧化生成D(![]() ),化学方程式为
),化学方程式为![]() 。答案为:
。答案为:![]() ;
;
(4)⑤为![]() 与(CH3CO)2O在浓硫酸的催化作用下反应生成
与(CH3CO)2O在浓硫酸的催化作用下反应生成 和CH3COOH,则反应类型为取代反应,⑧为
和CH3COOH,则反应类型为取代反应,⑧为![]() 与
与![]() 反应生成
反应生成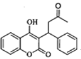 ,反应类型为加成反应。答案为:取代反应;加成反应;
,反应类型为加成反应。答案为:取代反应;加成反应;
(5)F 的同分异构体中,同时符合:a.能与 FeCl3 溶液发生显色反应、b.含有-CHO条件的同分异构体共有13种。它们为苯环上有-OH(酚)、-CH2CHO两个取代基的异构体3种,苯环上有-OH(酚)、-CHO、-CH3三个取代基的异构体10种。其中核磁共振氢谱为五组峰的结构简式为![]() 。答案为:13;
。答案为:13;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
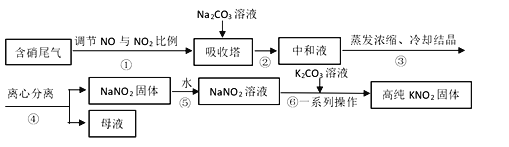
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3→3
+8HNO3→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 相对分子质量 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 100 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 146 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如图装置的三颈烧瓶中加入16 mL 50%的硝酸(过量,密度为1.310 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。请回答下列问题:
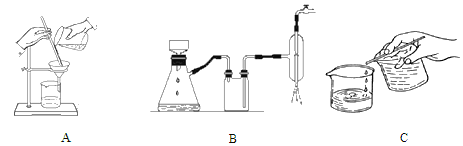
(1)装置b的名称为__________,使用时要从_________(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是________________。
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____________________。
(3)本实验所用的50%的硝酸物质的量浓度为____________;实验中,氮氧化物废气(主要成分为NO和NO2)可以用NaOH溶液来吸收,其主要反应为NO+NO2+2NaOH == 2NaNO2+H2O。其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的方程式:______________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或______洗涤晶体。
(5)通过称量得到产物7.00 g,则本实验产率为__________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图乙所示。

则下列结论正确的是(双选) ( )。
A.该反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.若其他条件不变,升高温度,平衡将向逆反应方向移动
C.若其他条件不变,开始时将该容器压缩为1 L,则反应将按图丙进行
D.若其他条件不变,使用适当的催化剂,则反应可以按图丙进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
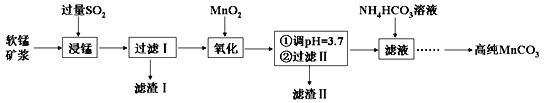
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
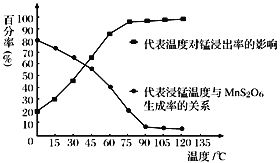
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述错误的是( )
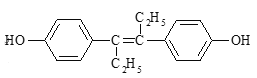
A.乙烯雌酚能发生取代、加成、氧化反应
B.乙烯雌酚可分别与NaOH、NaHCO3溶液反应
C.每1mol该有机物最多可以与含5molBr2的溴水反应
D.该有机物分子中最多有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A~H的相互转化关系如图所示(图中副产物均未写出):
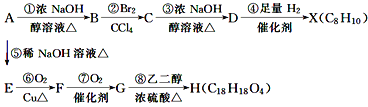
其中A的相对分子质量比X大34.5,请回答:
(1)写出有机物的结构简式:A__;H__。
(2)写出下列反应的化学方程式:
反应③__。
(3)B分子内处于同一平面上的原子最多有__个,B在一定条件下可以发生反应生成高分子化合物N,则N的结构简式为__。
(4)化合物M是G的一种同分异构体,M具有如下性质:
①不与NaHCO3反应,②遇FeCl3溶液显紫色,③1molM恰好与2molNaOH反应,
则M的结构简式为__(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
Ⅰ.为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
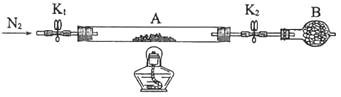
(1)仪器B的名称是______。
(2)将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.持续通氮气,冷却至室温
(3)根据实验记录,计算绿矾化学式中结晶水数目x=______(列式表示)。
Ⅱ.已知某些硫酸盐受热易分解为相应的氧化物,为探究硫酸亚铁的分解产物,将实验Ⅰ中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
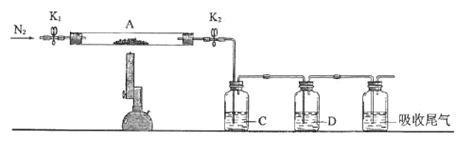
(4)C中盛放BaCl2溶液,并在实验中观察到有白色沉淀生成,其作用为:______。
(5)D中盛放的溶液为______(填标号)。
a.品红 b.NaOH c.Ba(NO3)2 e.浓H2SO4
(6)写出硫酸亚铁高温分解反应的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com