
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图乙所示。

则下列结论正确的是(双选) ( )。
A.该反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.若其他条件不变,升高温度,平衡将向逆反应方向移动
C.若其他条件不变,开始时将该容器压缩为1 L,则反应将按图丙进行
D.若其他条件不变,使用适当的催化剂,则反应可以按图丙进行
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】A是一种常见的烃,它的摩尔质量为40g·mol-1,C能发生银镜反应,E能与小苏打反应产生气体,它们之间存在如下图所示的转化关系(反应所需条件已略去):
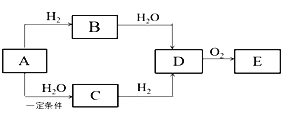
请回答:
(1) A的结构简式_______。
(2) C中含有官能团的名称是_______。
(3)在加热和催化剂条件下,D生成E的反应化学方程式为________。
(4)下列说法正确的是________。
a. B、C和E都能使酸性KMnO4溶液褪色
b. D和E都可以与金属钠发生反应
c. D和E在一定条件下反应可生成有香味的油状物质
d. 等物质的量B和D完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
氧化亚铜(Cu2O)可用于陶瓷、固体整流器。可用反应制备:2(CuSO4·5H2O) ![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为_______________。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因__________________。
(2)已知H2SO4的结构式如图所示: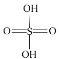 。上述反应中:
。上述反应中:
①在上述产物中,VSEPR模型与硫酸相同的是_________(填化学式,下同),与NO3-互为等电子体的一种分子是________。
②SO32-的杂化类型是________,请比较键角的大小:SO32-_____SO42-(填“>”“<”或“=”)
(3)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)四方晶系CuFeS2晶胞结构如图所示。已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______。
(2)写出A分别与B、C、D所形成化合物的化学式:_________、_________、_________。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于那类物质?__________写出它们相互反应的化学方程式。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
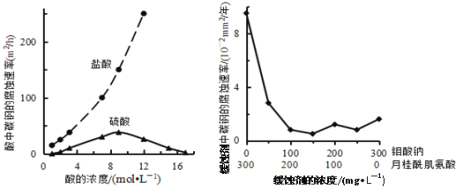
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
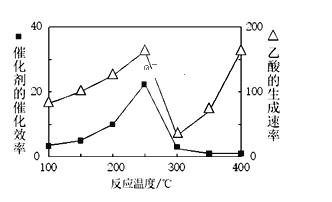
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
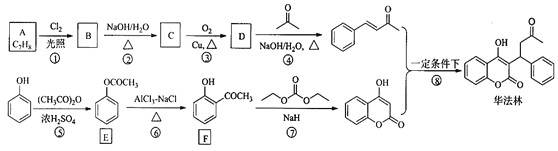
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com