
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:
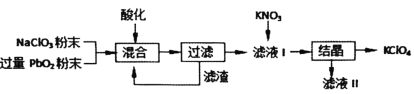
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物.请回答以下问题:
⑴基态氮原子的价电子排布式是____________。
⑵肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物.
①请用价电子层对互斥理论推测NH3分子的空间构型是__________________,其中H—N—H的键角为___________________,请根据价层电子对互斥理论解释其键角小于109°28′的原因:_______。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l) +2N2H4(l)═3N2(g)+4H2O(g) △H=-1038.7kJ·mol﹣1
若该反应中有4mol N—H 键断裂,则形成π 键的数目为__________。
⑶比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
①CHCl3+Cl2![]() CCl4+HCl
CCl4+HCl
②2HI+Cl2=2HCl+I2
③CH4+2O2![]() CO2+2H2O
CO2+2H2O
④CH3CH2CN+Cl2![]()
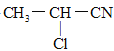 +HCl
+HCl
⑤CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
A.仅①B.仅①②③④C.仅①④⑤D.仅②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
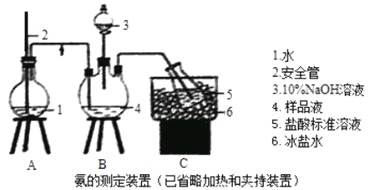
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() )提取氧化铝作冶炼铝的原料,提取的操作过程如下:
)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)反应1结束后的操作名称为_______。
(2)滤渣的主要成分是___________________。
(3)反应2中通入的过量气体为________
a. 二氧化碳 b.氨气 c.氮气
(4)写出B煅烧生成Al2O3的化学反应方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
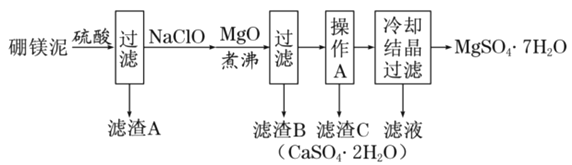
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com