
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%。目前我国已经在技术上取得突破――用硫酸渣炼铁。Fe3+开始沉淀为氢氧化物的pH=1,沉淀完全时的pH为3.7。某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:

请回答:
(1)写出固体E的化学式:__________________。试剂①是_______
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是_________
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:__________________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为 。
方案二:

(5)此方案制得的氧化铝含有的主要杂质是:_______________
(6)写出由溶液M固体乙这个过程中,主要化学反应的离子方程式:
_____________________;___________________
【答案】(1)Mg(OH)2 ;A;
(2)C;
(3)NaCl、NaHCO3 ;
(4)灼烧(或加热) ;
(5)二氧化硅;
(6) AlO2- +CO2+2H2O=Al(OH)3 + HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
【解析】
试题分析:根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝。
(1)固体E是氢氧化镁,试剂①是强碱溶液,故选A;故答案为:Mg(OH)2;A;
(2)因pH值精确到小数点后一位,而石蕊试液测得的pH值在一个范围内,广泛pH试纸测得的pH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:C;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,故答案为:NaCl、NaHCO3;
(4)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(5)产品不纯,最后产物中含有大量的二氧化硅,故答案为:二氧化硅;
(6)溶液主要含有硅酸钠和偏铝酸钠,硅酸钠和二氧化碳反应生成硅酸沉淀和碳酸氢钠,方程式为:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2- +CO2+2H2O=Al(OH)3 + HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO32-;AlO2- +CO2+2H2O=Al(OH)3 + HCO3-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________
(2)实验过程中,装置B、C中发生的现象分别是_______________、______________,这些现象分别说明SO2具有的性质是______和 。装置B中发生反应的离子方程式为_________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。
(5)碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式
除去CO2中含有的少量SO2可选择通过 溶液 。
(6)描述实验室稀释浓硫酸的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.合成氨反应中为了提高正反应速率,及时抽走氨气
B.SO2催化氧化中通入过量空气可提高SO2的平衡转化率
C.合成氨中加入催化剂可提高氮气的平衡转化率
D.合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

(1)请写出A的结构简式 ;
(2)写出反应B+C→D的化学方程式 ;
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol;
(4)制备D的实验装置图如图所示:收集产物的试管中盛放的液体为 ;
装置中长颈漏斗除起冷凝作用外,另一重要作用是: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
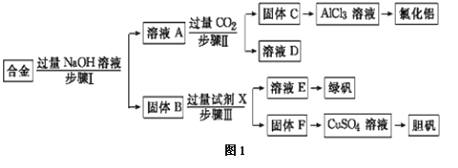
请回答:
(1)写出步骤Ⅱ反应的离子方程式: 。
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪器有 。
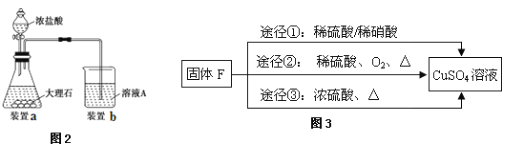
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 。
(4)从溶液E得到绿矾晶体的实验操作是 。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式: ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 。
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。请写出阳极电极反应式 ,阳极产生 L气体(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日23:30左右,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)和金属钠等危险化学品。
(1)钠在周期表中的位置是 ,实验室少量的钠保存于 中。
(2)NaCN的电子式是 。
(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡。氰化钠易溶于水,水溶液呈强碱性。氰化钠泄露可用双氧水或硫代硫酸钠中和。
①用离子方程式表示其水溶液呈强碱性的原因: 。
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的离子方程式 ;
③用硫代硫酸钠中和的离子方程式为:CN-+S2O32- = A+SO32-,A为 (填化学式)。
④可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com