
【题目】氮、磷化合物用途非常广泛,如:磷化硼(BP)、磷青铜(Cu3SnP)等。回答问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_____。
(2)PH3分子的空间构型为______。PH3的键角小于NH3的原因是_____。
(3)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为_____,该化合物所含元素中电负性最大的是_______。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为______,其为_____元酸,原因是_____。
(5)磷化硼(BP)是倍受关注的耐磨材料,可用作金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。
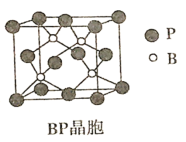
①磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为_____g/cm3。
【答案】5s25p2 三角锥形 元素的电负性N>P,成键电子对离中心原子越近,成键电子对之间的排斥力越大,键角越大 sp3杂化 O 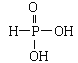 二 酸的元数与其形成的盐种类数目相同 正方形
二 酸的元数与其形成的盐种类数目相同 正方形 
【解析】
(1)Sn是50号元素,位于元素周期表第五周期第IVA族,根据构造原理书写基态锡原子的价电子排布式;
(2)PH3与NH3空间构型相同,结合P、N元素的电负性及电子对之间的排斥力大小比较;
(3)根据价层电子对数判断O原子杂化轨道类型;根据元素的非金属性越强,其电负性越大分析判断;
(4)只有羟基(-OH)氢能够与NaOH发生中和反应,酸是几元酸,就可形成几种盐据此分析判断;
(5)①该BP晶体在Z轴上投影,构成的是平面正方形结构;
②根据晶体密度ρ=![]() 计算;
计算;
(1)Sn是50号元素,位于元素周期表第五周期第IVA族,价层电子排布式是5s25p2;
(2) P原子价层电子对数为3+![]() =4,VSEPR构型为正四面体形,由于P原子上有1对孤对电子占据四面体的一个顶点,所以PH3呈三角锥形;由于元素的电负性:N>P,键合电子对偏向N,成键电子对之间的斥力大增大,电子对离中心原子更近,成键电子对之间的排斥力越大,键角越大,所以键角NH3比PH3的大;
=4,VSEPR构型为正四面体形,由于P原子上有1对孤对电子占据四面体的一个顶点,所以PH3呈三角锥形;由于元素的电负性:N>P,键合电子对偏向N,成键电子对之间的斥力大增大,电子对离中心原子更近,成键电子对之间的排斥力越大,键角越大,所以键角NH3比PH3的大;
(3)在-OH中O原子价层电子对数为4,因此杂化轨道类型为sp3杂化;在羟基磷灰石[Ca5(PO4)3OH]中含有的元素有Ca、P、O、H四种,由于元素的非金属性最强的元素是O元素,元素的非金属性越强,其电负性越大,因此物质所含元素电负性最大的是O元素;
(4)由于酸的元数与其和碱反应产生的盐种类数目相同,亚磷酸与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,说明H3PO3是二元酸,分子中含有2个与P原子连接的-OH,其结构式为 ;
;
(5)①根据磷化硼(BP)晶胞结构可知B原子在Z轴上投影,形成的是平面正方形结构;
②在1个晶胞中,含有P原子数目为8×![]() +6×
+6×![]() =4,4个B原子在晶胞内,所以含有B原子数目为4个,则该晶胞的密度ρ=
=4,4个B原子在晶胞内,所以含有B原子数目为4个,则该晶胞的密度ρ=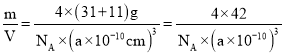 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氧有机化合物是重要的化学工业原料。完成下列填空:
(1)工业上,乙醇可以通过粮食发酵制取,也可由乙烯在一定条件下和__________反应制取。
(2)乙醇催化氧化生成乙醛,将铜丝在空气中灼烧变黑后,迅速伸入乙醇中,观察到铜丝表面________________;反复上述多次操作后,闻到刺激性气味,说明有_____________生成。
(3)乙醛中的官能团为____________。乙醛与环氧乙烷(![]() )互为____________。
)互为____________。
(4)写出检验乙醛的化学反应方程式:_______________________________________,上述反应显示乙醛具有__________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:

下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸测定某NaOH溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由红色变无色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
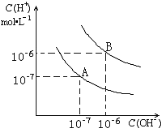
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“充电5秒钟,使用半个月”的石墨烯电池目前正处于实验研发阶段。它是利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性制作的一种新型二次电池。其工作原理如图所示,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列关于该电池的说法不正确的是( )
C6+LiCoO2。下列关于该电池的说法不正确的是( )
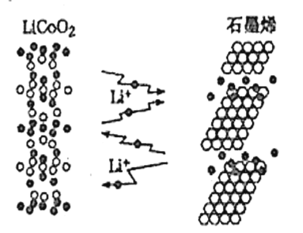
A.充电时,Li+移向石墨烯
B.充电时,转移0.5mol电子理论上阴极材料质量增加3.5g
C.放电时,LiCoO2极发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+
D.对废旧的该电池进行“放电处理”,让Li+从石墨烯中脱出有利于回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com