
【题目】(1)15.6gNa2X中含Na+0.4mol,则Na2X的摩尔质量是____________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是_________________(用含NA的式子表示)。
(3)某溶液由Mg2+、Al3+、Cl-、SO42- 4种离子组成,测得其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为___________。
(4)标况下,密度为1.25g/L的CO2与CH4组成的混合气体中,CO2的体积分数为______。
(5)将标准状况下体积为aL的HCl气体溶于1000g水中,得到盐酸的密度为bg/cm3,则该盐酸的物质的量浓度为______________mol/L。
(6)下列各项与胶体性质无关的有______________________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
【答案】78g/mol ![]() 3:3:1 42.86%
3:3:1 42.86% ![]() ④⑦⑨
④⑦⑨
【解析】
(1)先算出Na2X的物质的量,再算其摩尔质量;
(2)先求出cg氧气的物质的量,再利用标准状况下的气体摩尔体积求其体积;
(3)利用电荷守恒(溶液的电中性原则)进行求算;
(4)气体的体积分数在数值上等于其物质的量分数;
(5)利用物质的量浓度的定义式直接进行求算;
(6)胶体的知识主要有布朗运动,丁达尔现象、电泳、聚沉、渗析等;
(1)据Na2X的化学式知,含Na+0.4mol,则Na2X的物质的量为0.2mol,其质量为15.6g,所以Na2X的摩尔质量![]() ;
;
(2) ag氧气中含有的分子数为b,其物质的量为![]() mol,所以cg氧气的物质的量为
mol,所以cg氧气的物质的量为![]() ,其在标准状况下的体积为
,其在标准状况下的体积为![]() =
=![]() ;
;
(3) 在任何一种溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数。在该溶液中则有:c(Mg2+)×2+c(Al3+)×3=c(SO42-)×2+c(Cl-)×1。设Mg2+、Al3+、Cl-、SO42-的物质的量浓度分别为x、3a、13a、a,所以有2x+3×3a=a×2+13a,解得x=3a,所以溶液中c(Mg2+):c(Al3+):c(SO42-)=3a:3a:a=3:3:1;
(4) 设CO2和CH4的物质的量分别为n(CO2)、n(CH4)。CO2的体积分数等于物质的量分数即![]() =
=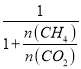 ,所以只需要求出
,所以只需要求出![]() 即可。据密度的本义有:
即可。据密度的本义有: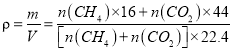 =1.25,求得
=1.25,求得![]() =
=![]() ,所以CO2的体积分数为
,所以CO2的体积分数为![]() =
=![]() ≈42.86%;
≈42.86%;
(5) 该HCl的物质的量为![]() mol,形成溶液的体积为
mol,形成溶液的体积为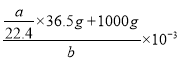 L,所以该盐酸的物质的量浓度c(HCl)=
L,所以该盐酸的物质的量浓度c(HCl)=![]() =
=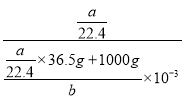 =
=![]() mol/L;
mol/L;
(6)①涉及的是胶体聚沉;②涉及的是胶体的聚沉;③涉及的是胶体的电泳;④涉及的是乳浊液的分离,与胶体无关;⑤涉及的是胶体的渗析;⑥涉及的是胶体的聚沉;⑦涉及的是中和反应,与胶体的性质无关;⑧均与水雾形成的胶体有关,涉及丁达尔现象;⑨臭氧消毒是利用了臭氧的氧化性,与胶体的性质无关;所以答案选择④、⑦、⑨。


科目:高中化学 来源: 题型:
【题目】一定条件下,向1L恒容密闭容器中通入2mol CO2和8mol H2发生反应:CO2(g) +4H2(g)![]() CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
A.0.16mol·L-1·min -1B.0.24mol·L-1·min -1C.0.64mol·L-1·min -1D.0.96mol·L-1·min -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法不正确的是

A. 当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B. 当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C. 当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D. 腐蚀之前原溶液中 c(Fe3+)=4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
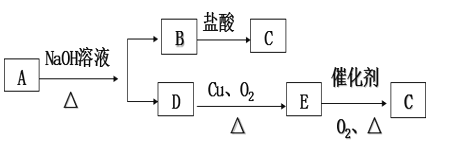
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
![]()
(1)若A是一种黄色单质固体,则B→C的化学方程式为__________________________。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为_____________,试用化学方程式表示该物质与二氧化碳气体的反应_______________________________。将C长期露置于空气中,最后将变成物质D,D的化学式为_____________。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为________。
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:

①收集A的方法是________,验证A是否已经收集满的方法是_________(任写一种)。
②写出实验室制取A的化学方程式____________________________。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为_______L。
④试写出C与水反应的化学方程式______________,反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式____________________。实验完毕后,试管中收集到的气体的主要成分为 __________(写化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂环烃分子中两个或两个以上碳环共有两个以上碳原子的烃称为桥环烃,二环[4.1.0]庚烷(![]() )是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
)是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
A. 与环庚烯互为同分异构体
B. 所有的碳原子均在同一平面上
C. 一氯代物有4种(不考虑立体异构)
D. 1mol二环[4.1.0]庚烷完全燃烧时消耗10molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com