
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-akJ·mol-l(a>0),一定条件下在容积为5L的密闭容器中投入1molNH3和1molO2,2min末NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g) ΔH=-akJ·mol-l(a>0),一定条件下在容积为5L的密闭容器中投入1molNH3和1molO2,2min末NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2min末,c(H2O)=0.6mol·L-1
B.用氧气表示2min内的平均反应速率:v(O2)=0.25mol·L-1·min-1
C.2min时反应放出的热量等于0.1akJ
D.2min内,NH3的转化率小于O2的转化率
【答案】D
【解析】
A.初始投料为1molNH3和1molO2,容器体积为5L,根据题意列三段式有:

根据三段式可知2min末,c(H2O)=0.12mol·L-1,故A错误;
B.2min内氧气的浓度变化为0.1 mol·L-1,所以v(O2)=![]() =0.05 mol·L-1·min-1,故B错误;
=0.05 mol·L-1·min-1,故B错误;
C.根据热化学方程式可知当产生4molNO时放出的热量为akJ,2min内共生成0.4molNO,所以2min内放出的热量为0.1akJ,但不能说2min时这一时刻放出的热量为0.1akJ,故C错误;
D.氨气和氧气的初始投料相同,但单位时间内氧气的变化量更大,所以氧气的转化率更大,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )
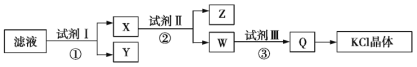
A. 始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示步骤中的2次过滤操作不可以合并
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯具有优异的电学、力学、热学等属性,将成为继石墨烯之后又一种“神奇纳米材料”。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法错误的是( )

A.“皱褶”式硼烯中每个硼原子共用3对电子
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼烯有望代替石墨烯作硼烯—锂离子电池的负极材料
D.氧化硼的水化物是一种弱酸,与过量OH-反应可生成B(OH)4-或BO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生反应生成中间体Fe。下列说法不正确的是
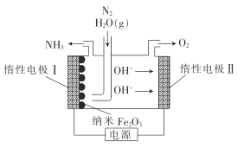
A.惰性电极II是电解池的阳极,发生氧化反应
B.生成氨气的反应:2Fe+N2+3H2O=Fe2O3+2NH3
C.惰性电极I的电极反应:Fe2O3+3H2O+6e -=2Fe+ 6OH-
D.产生2.24LO2时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3B.0≤c2≤0.42
C.X、Y的转化率相等D.当反应达到平衡时,反应就停止了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是![]() 中的某一种。
中的某一种。
(1) C的溶液呈蓝色,向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:
A_______,B_______,C_______,D_______。
(2)写出下列反应的离子方程式:
①A+C__________________________。
②D+盐酸________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO![]() [Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2
[Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为____。
(2)NH3分子空间构型为____。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_____,1molCH3COOCH=CH2中含![]() 键数目为____。
键数目为____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为_______。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构可用示意图表示为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com