
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
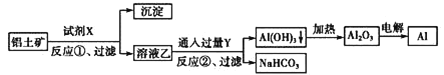
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O
【答案】C
【解析】
Al2O3、Fe2O3和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁,即试剂X为氢氧化钠,沉淀中含有氧化铁,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,Y为CO2,氢氧化铝加热分解生成氧化铝,电解可得铝,以此解答。
A、由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,故试剂X为氢氧化钠溶液,故A正确;
B、氧化铁与氢氧化钠不反应,反应①后过滤得到沉淀为氧化铁,故B正确;
C、反应①②是复分解反应,不属于氧化还原反应,而氧化铝电解是氧化还原反应,故C错误;
D、 反应①是氧化铝溶于氢氧化钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___(填序号)
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)如图是从海水中提取镁的简单流程。
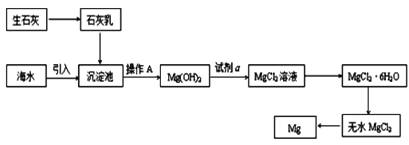
①操作 A是___。
②海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?___
(3)利用海底的“可燃冰”制作的酸性燃料电池的总反应式为:CH4+2O2=CO2+2H2O,则该燃料电池负极的电极反应式为____。
(4)海带灰中富含以 I- 形式存在的碘元素,实验室提取 I2的途径如图所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是____(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
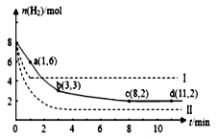
①a点正反应速率___(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是____mol/L。
③能够说明该反应达到化学平衡状态的标志是___。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A.12g金刚石中含有的共价键数目为4NA
B.3.2gCu与足量浓硝酸反应生成的气体分子数为0.1NA
C.标准状况下,2.24LCH3OH中含有的电子数为1.8NA
D.常温常压下,4.4gN2O和CO2的混合气体中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示。该反应是

A. N2(g)+3H2(g) ![]() 2NH3(g)B. C(s)+H2O(g)
2NH3(g)B. C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
C. H2(g)+I2(g) ![]() 2HI(g)D. Fe3+(aq)+3SCN-(aq)
2HI(g)D. Fe3+(aq)+3SCN-(aq) ![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
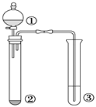
选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 氯气具有酸性、漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电—Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应,Fe2++H2O2=Fe3++OH-+OH,生成的烃基自由基(OH)能氧化降解有机污染物。下列说法正确的是( )
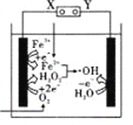
A. 电解池左边电极的电势比右边电极的电势高
B. 电解池中只有O2和Fe3+发生还原反应
C. 消耗1 molO2,电解池右边电极产生4mol OH
D. 电解池工作时,右边电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
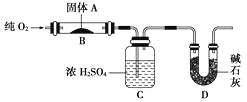
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com