
 ,
, ;
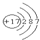
; 可知,氯原子最外层有7个电子,很容易得到1个电子,表现了较强的氧化性,
可知,氯原子最外层有7个电子,很容易得到1个电子,表现了较强的氧化性, 中最外层7个电子,最高正化合价为+7价;还可以得到1个电子达到8电子稳定结构,最低化合价为-1价,
中最外层7个电子,最高正化合价为+7价;还可以得到1个电子达到8电子稳定结构,最低化合价为-1价,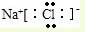 ;
; ;
; ;
; ,
,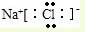 ;
;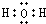 ;
;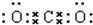 ;
; .
.


科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中通入过量CO2:2NH3?H2O+CO2═2NH4++CO32-+H2O |
| B、稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| C、钠与水反应Na+2H2O═Na++2OH-+H2↑ |
| D、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C是正极,发生氧化反应 |
| B、C是负极,发生氧化反应 |
| C、Fe是正极,发生还原反应 |
| D、Fe是负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙醇的水:加新制生石灰,蒸馏,收集馏出物 |
| B、检验淀粉的水解产物:在用酸作催化剂的水解液中直接加入新制Cu(OH)2溶液,然后加热,观察是否有红色沉淀生成 |
| C、除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| D、银氨溶液的配制:在洁净的试管中加2% AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com