
| V |
| Vm |
| 0.448L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、钠与氧气在常温下反应生成氧化钠 |
| B、将钠置于干燥的氧气中充分反应,可能有过氧化钠生成 |
| C、钠易与氧气反应,但不能跟其他非金属反应 |
| D、将钠置于空气中一段时间,可能有碳酸钠生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
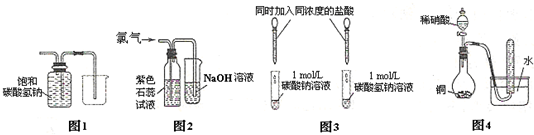
| A、①② | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
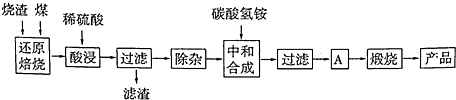
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
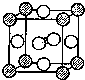 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com