
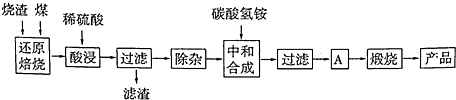
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
| Ksp |
| c(OH-)3 |
| 2.0×10-33 |
| (1×10-9)3 |
| bg×98% |
| 160g/mol |
| b×98% |
| 80 |
| ||
| ag |
| b×98.0%×56 |
| 80a |
| b×98.0%×56 |
| 80a |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、原子半径Y>Z,离子半径Z-<M2+ |
| B、MX2与水发生反应时,MX2只做氧化剂 |
| C、X、Y形成的化合物既能与强酸反应又能与强碱反应 |
| D、MX2、MZ2两种化合物中,都含有离子键和共价键,且阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
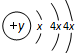
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、将一定量氨气通入0.1mol?L-1 NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、向CH3COONa溶液中滴加稀盐酸至中性时有:c(Cl-)>c(Na+)>c(CH3COOH) |
| D、等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com