
| A、等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、将一定量氨气通入0.1mol?L-1 NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、向CH3COONa溶液中滴加稀盐酸至中性时有:c(Cl-)>c(Na+)>c(CH3COOH) |
| D、等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |


科目:高中化学 来源: 题型:
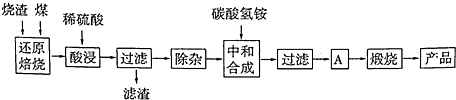
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
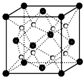 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.53g |
| B、4.80g |
| C、5.04g |
| D、8.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化镁投入过量盐酸 Mg3N2+6H+═3Mg2++2NH3↑ |
| B、用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ |
| C、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| D、硫酸铜溶液中滴加过量的氨水:Cu2++2 NH3?H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com