

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、将一定量氨气通入0.1mol?L-1 NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、向CH3COONa溶液中滴加稀盐酸至中性时有:c(Cl-)>c(Na+)>c(CH3COOH) |
| D、等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
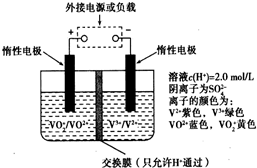 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:b点的比a点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调pH约为4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com