
| A、AlCl3 |
| B、FeCl3 |
| C、MgCl2 |
| D、ZnCl2 |


科目:高中化学 来源: 题型:
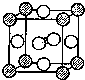 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化镁投入过量盐酸 Mg3N2+6H+═3Mg2++2NH3↑ |
| B、用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ |
| C、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| D、硫酸铜溶液中滴加过量的氨水:Cu2++2 NH3?H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、④⑥ |
| C、②③④⑤⑥ | D、②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C、将FeCl3溶液加热蒸干,可得到FeCl3固体 |
| D、0.10mol/L Al2(SO4)3溶液中Al3+数小于0.2NA(NA代表阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com