考点:晶体的类型与物质熔点、硬度、导电性等的关系,原子核外电子排布,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,“等电子原理”的应用,晶胞的计算
专题:化学键与晶体结构
分析:(1)①Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
②配合物Fe(CO)
x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
(2)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体;根据V=
进行计算;
(3)A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素;
B.同一周期元素中,元素的电负性随着原子序数的增大而增大;
C.晶格能与离子晶体的熔点成正比,离子半径与晶格能成反比,离子所带电荷与晶格能成正比;
D.根据价层电子对互斥理论确定分子构型,根据相似相溶原理分析;
E.分子晶体中,物质的熔沸点与其相对分子质量成正比;
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,W的原子序数为29,则W是Cu元素.
解答:
解:(1)①Fe原子核外有26个电子,核外电子排布为1s
22s
22p
63s
23p
63d
64s
2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe
3+,Fe
3+电子排布式为1s
22s
22p
63s
23p
63d
5,则M层电子排布式为:3s
23p
63d
5,
故答案为:3s
23p
63d
5;
②配合物Fe(CO)
x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
故答案为:5;分子晶体;
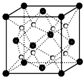
(2)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,该晶胞中钠离子个数是8,氧离子个数=8×
+6×=4,V=
=
=
cm
3,则a=
cm,
故答案为:立方体;
;
(3)A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以第一电离能大小:P>S>Si,故A错误;
B.同一周期元素中,元素的电负性随着原子序数的增大而增大,所以电负性顺序:C<N<O<F,故B正确;
C.晶格能与离子晶体的熔点成正比,离子半径与晶格能成反比,离子所带电荷与晶格能成正比,钙离子电荷大于钾离子,且钙离子半径小于钾离子,氯离子所带电荷小于氧离子,且氯离子半径大于氧离子,所以氯化钾的晶格能小于氧化钙,则氯化钾的熔点比氧化钙低,故C正确;
D.二氧化硫分子中硫原子的价层电子对是3且含有一个电子对,所以二氧化硫是V形结构,为极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水,故D错误;
E.分子晶体中,物质的熔沸点与其相对分子质量成正比,故D错误;
故答案为:BC;
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,W的原子序数为29,则W是Cu元素.
①Y
2X
2是乙炔,分子式为C
2H
2,碳氢原子之间存在σ键,碳碳三键中含有一个σ键,所以每个碳原子含有2个σ键,采取sp杂化,一个乙炔分子中含有3个σ键,所以1mol Y
2X
2含有σ键3mol,即为3 N
A或3×6.02×10
23个,
故答案为:sp杂化;3 N
A或3×6.02×10
23个;
②N原子电负性较大,C原子电负性较小,所以氨气分子中存在氢键,甲烷分子中不含氢键,氢键的存在导致氨气的沸点大于甲烷,
故答案为:NH
3分子存在氢键;
③CO
2和N
2O的原子个数相等、价电子数相等,所以是等电子体,故答案为:N
2O.
点评:本题考查物质结构和性质,涉及晶胞的计算、配合物成键、元素周期律等知识点,这些是学习难点,也是考查重点,同时考查学生空间想象能力,难度中等.

 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.


 X、Y、Z、W、Q为五种常见化合物,R为常见单质;X、Y、Z、Q的焰色反应均为黄色,常温下W、R均为无色无味气体.其转化关系如图所示(部分反应物、产物及反应条件已略去)
X、Y、Z、W、Q为五种常见化合物,R为常见单质;X、Y、Z、Q的焰色反应均为黄色,常温下W、R均为无色无味气体.其转化关系如图所示(部分反应物、产物及反应条件已略去)