
【题目】下列各表述与示意图一致的是( )
A.图①表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的p随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】A.用盐酸滴定氢氧化钠溶液,当恰好中和时溶液的pH=7,酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,题中图象变化与实际不相符,A不符合题意;
B.反应是放热反应,随温度升高平衡逆向进行,逆向反应平衡常数增大,正反应平衡常数减小,图象符合,图象中变化与实际上的变化相符,B符合题意;
C.随着浓度的减小,生成Mn2+的速率减小,所以生成Mn2+的物质的量的变化趋势减小,图象不符合,C不符合题意;
D.图象中使用催化剂降低反应活化能,但反应是放热反应,反应物能量高,图象中表示的吸热反应,D不符合题意;
所以答案是:B
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=﹣746.4kJmol﹣1 . 起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1molL﹣1s﹣1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1mol O2 , 正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
(1)Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系. 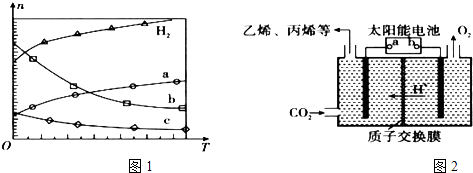
①该反应的△H0(填“>”、“=”或“<”).
②曲线b表示的物质为 .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示. b为电源的极,电解时,生成乙烯的电极反应式是 .
(3)Ⅱ.用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(答一种即可).
(4)Ⅲ.工业上可以用NaOH溶液或氨水吸收过量的SO2 , 分别生成NaHSO3、NH4HSO3 , 其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32﹣)较小的是 , 用文字和化学用语解释原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属元素a、b、c,在相同条件下,b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物的碱性强;a可以从c的盐溶液中置换出c.则这三种金属元素的金属性由强到弱的顺序是( )
A.a、b、c
B.b、a、c
C.b、c、a
D.c、b、a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是

A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。

回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com