
【题目】根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A. 两者都为s-s σ 键 B. 两者都为p-p σ 键
C. 前者为p-p σ 键,后者为s-p σ 键 D. 前者为s-s σ 键,后者为s-p σ 键
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素。![]()
请回答下列问题:
(1)T的离子结构示意图为______________;
(2)元素的非金属性为:Q_____________R(填“强于”或“弱于”);
(3)R元素的氢化物的电子式为________________;
(4)T的单质与同周期金属性最强元素最高价氧化物对应的水化物反应的离子方程式为______________________________________;
(5)T的单质与W的最高价氧化物的水化物浓溶液共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味。你猜想该气体是_________(填化学式),请你设计一个简单的实验方案证明你的猜想___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
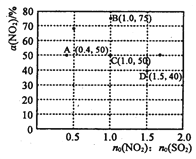
③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①11H与21H;②O2与O3;③CH3CH2CH2CH3与![]() ;④CH4与C3H8;⑤CH3CH2CH2CH3与
;④CH4与C3H8;⑤CH3CH2CH2CH3与 ![]() .请回答下列问题:
.请回答下列问题:
(1)互为同位素的是__(填序号,下同).
(2)互为同系物的是__.
(3)互为同分异构体的是__.
(4)属于同一种物质的是__.
(5)用习惯命名法命名![]() 的名称是__.
的名称是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,金属腐蚀造成的损失远远超过火灾、水灾等自然灾害的总和,越来越被世界各国所重视,下面金属的防腐措施中,使用牺牲阳极的阴极保护法的是
A.汽车底盘喷涂油漆 B.掺防腐的金属制成不锈钢菜刀
C.钢闸门连接电源负极 D.地下钢管连接锌块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的叙述中,正确的是 ( )
A.硫的非金属性较强,故只能以化合态存在于自然界中
B.能与Cu、Fe、O 2 等物质反应,S作氧化剂
C.硫燃烧得SO 3 ,可以制得硫酸
D.S与Cu反应生成Cu 2 S,而不能生成CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:

回答下列问题:
(1)处于平衡状态的时间段是__________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2) t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻__________;t3时刻__________;t4时刻__________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是______(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。_______
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,它是以铂作电极,以KOH溶液作电解质,下列叙述中不正确的是
A.H2在负极发生氧化反应
B.燃料电池的化学能可以全部转化为电能
C.产物为无污染的水,属于环境友好电池
D.供电时的总反应为:2H2 + O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
试回答下列问题:
1.为了使![]() 转化为
转化为![]() ,试剂①可以选用________,反应的离子方程式为:____________________________;
,试剂①可以选用________,反应的离子方程式为:____________________________;
2.加入试剂①后,能够分离得到![]() 沉淀的方法是________;
沉淀的方法是________;
3.试剂②可以选用________;
4.无水![]() 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生![]() 和
和![]() ,写出该反应的化学方程式____________________________。
,写出该反应的化学方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com