
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
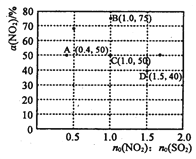
③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
【答案】 -41.8kJ/mol 共价键 SO2+2OH-=SO32-+H2O d 降低温度 c0/5t =
【解析】(1)由①2NO(g)+O2(g)![]() 2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)
2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6kJmol-1,根据盖斯定律可知,
2SO3(g)△H=-196.6kJmol-1,根据盖斯定律可知, ![]() 可得NO2(g)+SO2(g)═SO3(g)+NO(g),则△H=
可得NO2(g)+SO2(g)═SO3(g)+NO(g),则△H=![]() =-41.8kJmol-1,即NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJmol-1;
=-41.8kJmol-1,即NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJmol-1;
(2)在离子反应2NO2+2OH- =NO2- +NO3- +H2O中NO2分子内的化学键存在键的断裂和形成,生成NO3- 时形成了共价键;用NaOH溶液吸收少量SO2生成Na2SO3的离子方程式为SO2+2OH-=SO32-+H2O;
(3)①a.反应前后气体的总物质的量不变,体积不变,则气体的压强始终不变,无法判断是平衡状态,故a错误;b.气体的总质量和气体总物质的量始终不变,气体的平均摩尔质量始终是定值,无法判断是平衡状态,故b错误;c.气体的总质量和气体的体积始终不变,则气体的密度始终不变,无法判断是平衡状态,故c错误;d.NO2的体积分数不再随时间变化而变化,为平衡状态,故d正确;答案为d;
②在原料气配比不变的情况下,欲将图中C点的平衡状态改变为B点的平衡状态,NO2的转化率增大,说明平衡正向移动,可采取降温的措施来实施;
③ NO2+SO2![]() SO3+NO
SO3+NO
起始浓度(molL-1) 0.4c0 c0 0 0
变化浓度为 (molL-1) 0.4c0 ×0.5
经过t min达到平衡状态,该时段化学反应速率![]() (NO2)=
(NO2)= ![]() molL-1min -1=c0/5tmolL-1min -1;
molL-1min -1=c0/5tmolL-1min -1;
③Tc点 NO2+SO2![]() SO3+NO
SO3+NO
起始物质的量(mol) n n 0 0
变化物质的量 (mol) 0.5n 0.5n 0.5n 0.5n
平衡物质的量 (mol) 0.5n 0.5n 0.5n 0.5n
此时平衡常数Kc=![]() =1;
=1;
Tc点 NO2+SO2![]() SO3+NO
SO3+NO
起始物质的量(mol) 3 n 2 n 0 0
变化物质的量 (mol) 1.2n 1.2n 1.2n 1.2n
平衡物质的量 (mol) 1.8n 0.8n 1.2n 1.2n
此时平衡常数Kd=![]() =1=Kc,因平衡常数只与温度有关,则Tc=Td。
=1=Kc,因平衡常数只与温度有关,则Tc=Td。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,28 g CO 和 C2H4 混合气体中的碳原子数为 NA
B. 1 mol N2 与 3 mol H2 充分反应,产物的分子数为 2NA
C. 标准状况下,11.2 L 己烷中含有的碳碳键数为 2.5NA
D. 32 g 硫粉与足量的 Cu 粉完全反应,转移的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法中正确的是( )
A.合成纤维和光导纤维都是新型有机非金属材料
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.“玉不琢不成器”、“百炼方能成钢”发生的均为化学变化
D.“火树银花”中的焰火实质上是金属元素的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。

(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25molL﹣1min﹣1,下列说法正确的是( )
A. 该反应方程式中,x=1
B. 2min时,A的转化率为50%
C. 2min时,A的物质的量为0.75mol
D. 反应速率v(B)=0.25 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A. 两者都为s-s σ 键 B. 两者都为p-p σ 键
C. 前者为p-p σ 键,后者为s-p σ 键 D. 前者为s-s σ 键,后者为s-p σ 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 、
、![]() 、
、![]() 处于同一周期,
处于同一周期,![]() 元素的原子最外层电子数是次外层的2倍,
元素的原子最外层电子数是次外层的2倍,![]() 、
、![]() 、
、![]() 、
、![]() 具有相同电子层结构,下列说法正确的是( )
具有相同电子层结构,下列说法正确的是( )
A. 原子序数:![]() B. 原子半径:
B. 原子半径:![]() C. 最简单氢化物的热稳定性:
C. 最简单氢化物的热稳定性:![]() D. 离子半径:
D. 离子半径:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com