
【题目】MgCl2·6H2O可用于医药、农业等领域。一种用镁渣[含有MgCO3、Mg(OH)2、CaCO3、Fe2O3和SiO2]制备MgCl2·6H2O的实验流程如下:

(1)“煅烧”只有MgCO3、Mg(OH)2发生分解。“煅烧”须用到下列仪器中的________(填字母)。
A. 蒸发皿 B. 坩埚 C. 泥三角
(2) “蒸氨”在如图所示装置中进行(NH4Cl溶液仅与体系中的MgO反应)。

①三颈烧瓶中发生主要反应的离子方程式为______________。
②倒扣漏斗的作用是________________。
③烧杯中溶液红色深浅不再变化可判断“蒸氨”已完成,其原因是________________。
(3) “过滤”所得滤液经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。向所得产品中加入蒸馏水,测得溶液呈碱性,其可能原因是_________________。
(4) 请补充完整以“滤渣”为原料,制取FeSO4溶液的实验方案:边搅拌边向滤渣中加入1.0 mol·L-1盐酸,_________,得FeSO4溶液(实验中必须用的试剂:1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 H2SO4溶液、铁粉、蒸馏水)。
已知部分金属离子形成氢氧化物沉淀的pH范围如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Ca2+ | 11.3 | — |
Mg2+ | 8.4 | 10.9 |
【答案】BC MgO+2NH4+![]() Mg2++2NH3↑+H2O 防止倒吸 此时烧杯中溶液pH不再变化,说明三颈烧瓶中已无NH3逸出,即“蒸氨”完成 过度蒸发导致MgCl2水解,产品中含Mg(OH)2或Mg(OH)Cl 当溶液中不再产生气泡时,过滤;向滤液中分批加入1.0 mol·L-1NaOH溶液至pH介于3.2~8.4,过滤;用蒸馏水洗涤滤渣2~3次后,加入1.0 mol·L-1H2SO4溶液直至滤渣完全溶解,边搅拌边向所得溶液分批加入铁粉,当有固体不能溶解时,过滤。
Mg2++2NH3↑+H2O 防止倒吸 此时烧杯中溶液pH不再变化,说明三颈烧瓶中已无NH3逸出,即“蒸氨”完成 过度蒸发导致MgCl2水解,产品中含Mg(OH)2或Mg(OH)Cl 当溶液中不再产生气泡时,过滤;向滤液中分批加入1.0 mol·L-1NaOH溶液至pH介于3.2~8.4,过滤;用蒸馏水洗涤滤渣2~3次后,加入1.0 mol·L-1H2SO4溶液直至滤渣完全溶解,边搅拌边向所得溶液分批加入铁粉,当有固体不能溶解时,过滤。
【解析】
镁渣[含有MgCO3、Mg(OH)2、CaCO3、Fe2O3和SiO2]在坩埚中煅烧,碳酸镁、氢氧化镁分解得到氧化镁,加入氯化铵反应生成氯化镁、氨气和水,蒸氨,氨气极易溶于水,注意防倒吸,过滤后再经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品MgCl2·6H2O。
(1)“煅烧”只有MgCO3、Mg(OH)2发生分解。“煅烧”须用到的仪器主要是酒精灯,三脚架、泥三角、坩埚、玻璃棒、坩埚钳;故答案为:BC。
(2)①三颈烧瓶中NH4Cl溶液仅与体系中的MgO反应,氯化铵水溶液显酸性,和碱性氧化物反应生成镁离子、氨气和水,发生主要反应的离子方程式为MgO+2NH4+![]() Mg2++2NH3↑+H2O;故答案为:MgO+2NH4+
Mg2++2NH3↑+H2O;故答案为:MgO+2NH4+![]() Mg2++2NH3↑+H2O。
Mg2++2NH3↑+H2O。
②由于反应生成了氨气,将氨气蒸出,则烧杯中吸收氨气,由于氨气极易溶于水,因此倒扣漏斗的作用是防止倒吸;故答案为:防止倒吸。
③氨气极易溶于水,烧杯中溶液红色深浅不再变化,说明氨气的量不再被蒸出即说明三颈烧瓶中已无NH3逸出,“蒸氨”完成,因此烧杯中溶液pH不再变化;故答案为:此时烧杯中溶液pH不再变化,说明三颈烧瓶中已无NH3逸出,即“蒸氨”完成。
(3)向所得产品中加入蒸馏水,测得溶液呈碱性,低温蒸干得到氯化镁,如果温度过高或则过度蒸发会导致MgCl2水解,水解生成Mg(OH)2,因此产品中含Mg(OH)2或Mg(OH)Cl;故答案为:过度蒸发导致MgCl2水解,产品中含Mg(OH)2或Mg(OH)Cl。
(4)滤渣主要是碳酸钙、氧化铁、二氧化硅及少量含镁的物质,边搅拌边向滤渣中加入1.0 mol·L1盐酸,当溶液中不再产生气泡时,过滤,得到滤渣为二氧化硅,滤液主要是氯化铁、氯化钙,向滤液中分批加入1.0 mol·L1 NaOH溶液至pH介于3.2~8.4,过滤,得到滤渣氢氧化铁,用蒸馏水洗涤滤渣2~3次后,加入1.0 mol·L1 H2SO4溶液直至滤渣完全溶解,边搅拌边向所得溶液分批加入铁粉,当有固体不能溶解时,过滤;故答案为:当溶液中不再产生气泡时,过滤,得到滤渣为二氧化硅,滤液主要是氯化铁、氯化钙,向滤液中分批加入1.0 mol·L1 NaOH溶液至pH介于3.2~8.4,过滤,得到滤渣氢氧化铁,用蒸馏水洗涤滤渣2~3次后,加入1.0 mol·L1 H2SO4溶液直至滤渣完全溶解,边搅拌边向所得溶液分批加入铁粉,当有固体不能溶解时,过滤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和FeB.Ag和AlC.Mg和AlD.Zn和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
硫酸 化学纯(CP)
(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为________(填序号)。
(2)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制240 mL 0.1 mol·L-1的稀硫酸,需取该浓硫酸________ mL,计算所需浓硫酸的体积用到的公式___________。
(3)接下来完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、___________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是_________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为________。
(5)下列操作会使所配溶液浓度偏高的是____(填字母)。
A 转移溶液时未洗涤烧杯
B 定容时俯视容量瓶的刻度线
C 容量瓶用蒸馏水洗净后仍残留有蒸馏水
D 用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素推断题。
根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第三周期VIIA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为_______、________,C、D的元素名称分别为________、_______。B、D两元素在周期表中所在的位置分别是________、____________。
(2)写出B、C的单质在加热时的反应方程式:_____________。
(3)从原子结构的角度分析,C原子与D原子的__________相同。写出A的单质与水反应的离子方程式_______________,D的单质与C的氧化物的水化物溶液反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化:

下列有关说法正确的是( )
A.X和Y分子中各含有1个手性碳原子
B.Y能发生加成反应、取代反应和消去反应
C.1 mol Y与足量NaOH溶液反应,最多消耗2 mol NaOH
D.1 mol Z与足量浓溴水反应,最多消耗2 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )
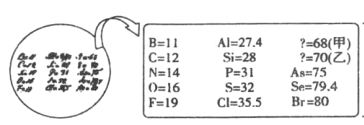
A.推测乙可以用作半导体材料
B.原子半径比较:甲>乙![]()
C.元素乙的简单气态氢化物的稳定性比![]() 弱
弱
D.元素甲的原子序数为21
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com