
【题目】羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化:

下列有关说法正确的是( )
A.X和Y分子中各含有1个手性碳原子
B.Y能发生加成反应、取代反应和消去反应
C.1 mol Y与足量NaOH溶液反应,最多消耗2 mol NaOH
D.1 mol Z与足量浓溴水反应,最多消耗2 mol Br2
【答案】AB
【解析】
X中含有酚羟基、酯基、醇羟基,发生分子内取代反应生成Y,再发生消去反应生成X,根据手性碳原子的定义判断其个数,根据分子中的官能团判断其反应情况以及消耗反应物的量。
A.连接4个不同基团的C为手性C,则X中与醇OH、甲基相连的C为手性碳,Y中与醇OH、甲基相连的C为手性碳,可知均只有1个手性碳原子,故A正确;
B.Y含酚-OH、醇-OH、-COOC-均可发生取代反应,含苯环可发生加成反应,含醇-OH可发生消去反应,故B正确;
C.Y中酚-OH、-COOC-及水解生成的酚-OH均与NaOH反应,1molY最多可与3molNaOH反应,故C错误;
D.酚-OH的邻、对位与溴水发生取代反应,羟甲香豆素(Z)中还含碳碳双键与溴水发生加成反应,则羟甲香豆素(Z)分别与溴水反应,最多消耗Br2的物质的量之比为3mol,故D错误。
答案选AB。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】用镁—次氯酸钠燃料电池作电源模拟消除工业酸性废水中的![]() 的过程(将
的过程(将![]() 还原为
还原为![]() ),装置如图所示。下列说法正确的是
),装置如图所示。下列说法正确的是

A.燃料电池负极反应式为![]()
B.装置中电子的流动路线是c电极→惰性电极→金属铁电极→d电极
C.装置工作过程中消耗![]() ,理论上可消除
,理论上可消除![]()
D.将![]() 处理后的废水比原工业废水的pH小
处理后的废水比原工业废水的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2·6H2O可用于医药、农业等领域。一种用镁渣[含有MgCO3、Mg(OH)2、CaCO3、Fe2O3和SiO2]制备MgCl2·6H2O的实验流程如下:

(1)“煅烧”只有MgCO3、Mg(OH)2发生分解。“煅烧”须用到下列仪器中的________(填字母)。
A. 蒸发皿 B. 坩埚 C. 泥三角
(2) “蒸氨”在如图所示装置中进行(NH4Cl溶液仅与体系中的MgO反应)。

①三颈烧瓶中发生主要反应的离子方程式为______________。
②倒扣漏斗的作用是________________。
③烧杯中溶液红色深浅不再变化可判断“蒸氨”已完成,其原因是________________。
(3) “过滤”所得滤液经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。向所得产品中加入蒸馏水,测得溶液呈碱性,其可能原因是_________________。
(4) 请补充完整以“滤渣”为原料,制取FeSO4溶液的实验方案:边搅拌边向滤渣中加入1.0 mol·L-1盐酸,_________,得FeSO4溶液(实验中必须用的试剂:1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 H2SO4溶液、铁粉、蒸馏水)。
已知部分金属离子形成氢氧化物沉淀的pH范围如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Ca2+ | 11.3 | — |
Mg2+ | 8.4 | 10.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO(s)
MgO(s)
B.H2SO4(浓)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(s)
Fe(s)
D.SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺(![]() )等作为原料制备。
)等作为原料制备。
(1) Fe2+基态核外电子排布式为________,PO43-的空间构型为________(用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是____(填元素符号)。
(3) 1 mol![]() 含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
(4) 一个LiCl晶胞(如图)中,Li+数目为________。
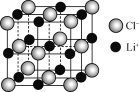
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
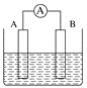
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。

(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成氢氧化钠与盐酸的反应的实验。

回答下列问题:
(1)反应后混合溶液的温度与反应前盐酸和氢氧化钠溶液的温度相比较其变化是___________________________________。
(2)你认为酸碱中和反应是放热反应还是吸热反应____________________________________。
(3)写出该反应的离子方程式:____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com