
| c(NH4+) |
| c(OH-) |
| 1 |
| 50 |
| 10-14 |
| 10-3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 与
与
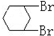 与
与
 与
与
 与
与
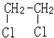 与CH3-CH2Cl
与CH3-CH2Cl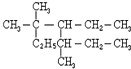 是某有机物结构简式,按系统命名法,该有机物的命名正确的是
是某有机物结构简式,按系统命名法,该有机物的命名正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
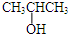 ⑨CH≡CH.
⑨CH≡CH.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.
(1)双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.
查看答案和解析>>
科目:高中化学 来源: 题型:
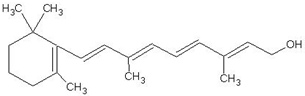
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某氨水的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b-1 |
| B、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、若10mLpH=a的硫酸溶液跟100mLpH=b的NaOH溶液混合后,溶液呈中性,则a+b=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
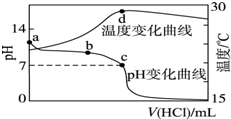 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)<1.0×10-14mol/L |
| B、b点:n(NH4+)+n(NH3?H2O)>n(Cl-) |
| C、b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL |
| D、d点后,温度略下降的主要原因是生成的NH4Cl水解吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com