
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿。软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol·L﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图所示。请回答下列问题:
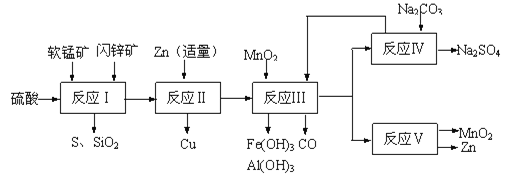
(2)反应Ⅰ后过滤所得滤液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子。试写出反应Ⅰ中生成CuSO4的化学方程式____________。
(3)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式为_________。
(4)反应Ⅲ中加入MnO2的作用是(离子方程式表示)______________________。
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为__________。
(6)图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是___________。

【答案】60% MnO2 + CuS+ 2H2SO4 = S↓+ MnSO4+ CuSO4+ 2H2O Zn+Fe2+=Zn2++Fe 或 Zn+Mn2+=Zn2++Mn 4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O Mn2+-2e-+2H2O=MnO2+4H+ 趁热过滤 防止Na2SO4固体因溶解而减少;避免形成结晶水合物
【解析】
(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣,
MnO2~I2~2S2O32-,
1 2
n 0.1000molL-1×0.050L
n=0.0025mol,1L溶液中含MnO2物质的量=0.0025mol×![]() =0.1mol,则软锰矿中MnO2含量=
=0.1mol,则软锰矿中MnO2含量=![]() ×100%=60%;
×100%=60%;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4、MnSO4和硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S+CuSO4+MnSO4+2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是与铁离子反应生成亚铁离子、把铜离子转化为铜除去;锌过量会继续反应置换出铁(或锰);反应的离子方程式为:Zn+Fe2+=Fe+Zn2+(或Zn+Mn2+=Mn+Zn2+);
(4)反应Ⅲ中加入MnO2的作用是将Fe2+氧化为Fe3+,发生的反应离子方程式为4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O;
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,二氧化锰是在阳极锰离子失电子生成,故阳极发生的电极反应可表示为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)图象分析可知温度较高时析出硫酸钠且浓度越高其溶解度越小,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,故答案为:趁热过滤,防止Na2SO4固体因溶解而减少;避免形成结晶水合物Na2SO410H2O晶体。


科目:高中化学 来源: 题型:
【题目】材料与化学密切相关,表中对应系错误的是w.w.w.k.s.5.u.c.o.m
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,
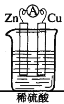
其正极反应式:_________________________;负极反应式: ____________;总反应方程式:_________________。若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成原电池,回答下列问题。
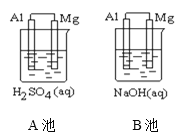
(1)该装置是把___________ 能转化为_________能的装置。
(2)A池中Mg电极是__________(填“正”或“负”)极,其在反应中_____(填“得到”或“失去”)电子,该极发生的反应是__________(填“氧化”或“还原”)反应,其电极反应为________________________,该装置中电流的方向是由_____到 ______。
(3)B池中负极材料是_________,该装置中电子的移动方向是由_____到 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
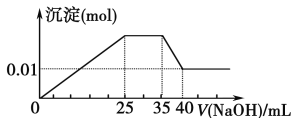
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=1∶1∶2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、CO2
C.HBr、CCl4、H2O、CO2
D.Na2O2、H2O2、H2O、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
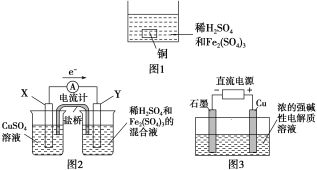
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. AlCl3![]() Al(OH)3
Al(OH)3 ![]() [Al(OH)4 ]-
[Al(OH)4 ]-
B. Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
C. NaHCO3(s)![]() Na2CO3
Na2CO3![]() NaOH(aq)
NaOH(aq)
D. Al(s)![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com