
【题目】如图所示,组成原电池,回答下列问题。
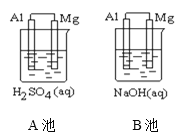
(1)该装置是把___________ 能转化为_________能的装置。
(2)A池中Mg电极是__________(填“正”或“负”)极,其在反应中_____(填“得到”或“失去”)电子,该极发生的反应是__________(填“氧化”或“还原”)反应,其电极反应为________________________,该装置中电流的方向是由_____到 ______。
(3)B池中负极材料是_________,该装置中电子的移动方向是由_____到 ______。
【答案】化学 电 负 失去 氧化 Mg—2e—=Mg2+ Al Mg Al Al Mg
【解析】
(1)原电池把化学能转化为电能;
(2)原电池中活泼金属做负极,负极失电子发生氧化反应;原电池中电流由正极经导线流向负极;
(3)B池中铝与氢氧化钠溶液反应,铝失电子发生氧化反应,铝是负极、镁是正极。原电池中电子由负极经导线流向正极。
(1)该装置为原电池是把化学能转化为电能的装置;
(2)镁的活泼性大于铝,A池中Mg电极是负极,Mg在反应中失去电子,发生氧化反应,其电极反应为Mg—2e—=Mg2+,原电池中电流由正极经导线流向负极,该装置中电流的方向是由Al到 Mg。
(3)B池中铝与氢氧化钠溶液反应,铝失电子发生氧化反应,Al是负极、Mg是正极。原电池中电子由负极经导线流向正极,电子的移动方向是由Al到 Mg。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯和乙烯的叙述中正确的是( )
A.两者都容易发生取代反应
B.两者都可以与溴水发生加成反应
C.两者分子中所有原子都在同一平面内
D.两者都含有碳碳双键,能与酸性KMnO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO![]() 、K+、Cl-、Na+
、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO![]() 、Mg2+、Na+、SO
、Mg2+、Na+、SO![]()
C. 在![]() =1×1012的溶液中:NH
=1×1012的溶液中:NH![]() 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO![]()
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO
=10-14mol·L-1的溶液中:Na+、HCO![]() 、Cl-、K+
、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法,正确的是( )
A.构成单质的分子中一定含有共价键
B.由非金属元素组成的化合物可能是离子化合物
C.非极性键只存在单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的![]() 和
和![]() 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黄色)+2H+
(黄色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________。
(2)关于第①步反应,下列说法正确的是________(填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min后测得B口的气体体积为C口处的一半,下列说法不正确的是
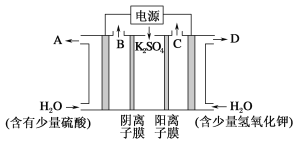
A. 电源左侧为正极
B. 电解槽左侧的电极反应方程式为2H2O-4e-==O2↑+4H+
C. D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D. 标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO42-通过阴离子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿。软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol·L﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图所示。请回答下列问题:
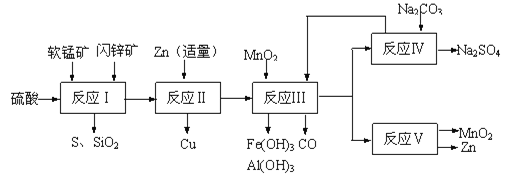
(2)反应Ⅰ后过滤所得滤液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子。试写出反应Ⅰ中生成CuSO4的化学方程式____________。
(3)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式为_________。
(4)反应Ⅲ中加入MnO2的作用是(离子方程式表示)______________________。
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为__________。
(6)图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
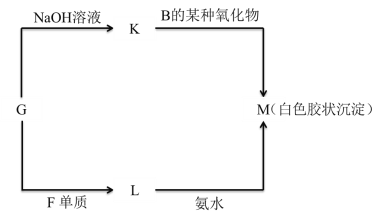
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com