
【题目】下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO![]() 、K+、Cl-、Na+
、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO![]() 、Mg2+、Na+、SO
、Mg2+、Na+、SO![]()
C. 在![]() =1×1012的溶液中:NH
=1×1012的溶液中:NH![]() 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO![]()
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO
=10-14mol·L-1的溶液中:Na+、HCO![]() 、Cl-、K+
、Cl-、K+
【答案】B
【解析】
本题考查给定条件下离子共存问题。pH试纸变红呈酸性,酸与弱酸根离子不能共存;水电离产生的c(OH-)=1×10-10mol·L-1的溶液中可能呈酸性或碱性,酸与弱酸根离子不能共存,碱与弱碱根离子不能共存;在![]() =1×1012的溶液呈碱性,碱与弱碱根离子不能共存
=1×1012的溶液呈碱性,碱与弱碱根离子不能共存![]() =10-14mol·L-1的溶液呈酸性,与弱酸的酸式酸根不能共存。
=10-14mol·L-1的溶液呈酸性,与弱酸的酸式酸根不能共存。
A.使pH试纸变红说明该溶液呈酸性,CO![]() 不能大量存在,故A错误;B.水电离产生的c(OH-)=1×10-10mol·L-1的溶液中,溶液可能呈酸性或碱性,Mg2+和OH-不能大量共存,但在酸性条件下这些离子可以共存,故B正确;C.常温下由
不能大量存在,故A错误;B.水电离产生的c(OH-)=1×10-10mol·L-1的溶液中,溶液可能呈酸性或碱性,Mg2+和OH-不能大量共存,但在酸性条件下这些离子可以共存,故B正确;C.常温下由![]() =1×1012,知c(OH-)>c(H+)溶液呈碱性,NH
=1×1012,知c(OH-)>c(H+)溶液呈碱性,NH![]() 、Fe2+不能大量存在,故C错误;D.由
、Fe2+不能大量存在,故C错误;D.由 ![]() =10-14mol·L-1的溶液呈酸性,溶液中HCO
=10-14mol·L-1的溶液呈酸性,溶液中HCO![]() 不能共存,故D错误;所以答案为:B。
不能共存,故D错误;所以答案为:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CO2是造成温室效应的废气,研究二氧化碳的利用具有十分重要的意义。CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=127.8 kJ/mol。请回答:
C2H4(g)+4H2O(g) ΔH=127.8 kJ/mol。请回答:
(1)已知:H2的燃烧热是285.8kJ/mol,且H2O(g)![]() H2O(l) ΔH=44.0 kJ/mol,则表示C2H4燃烧热的热化学方程式为__________________。
H2O(l) ΔH=44.0 kJ/mol,则表示C2H4燃烧热的热化学方程式为__________________。
(2)图l、图2分别是CO2的平衡转化率(α)随压强及温度的变化关系,已知Z为起始时的投料比,即Z=![]() 。
。
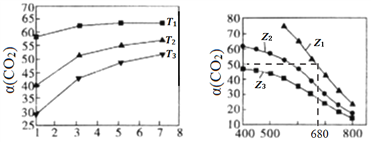
①图l中投料比相同,温度从低到高的顺序为________。
②图2中Z1、Z2、Z3投料比从大到小的顺序为________,理由是____________________。
③若要进一步提高CO2的平衡转化率,除了可以适当改变反应温度外,还可以采取的措施有________________。(任写一种)
(3)若图2中Z1=2.5,在温度为680 K、体积为2 L的恒容密闭容器中,充入1 mol H2和0.4 mol CO2,10 min后达到平衡状态。
①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②680 K时,反应的平衡常数K=________。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
②2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
下图是乙烯在相同时间内,不同温度下的产率,则高于T℃时乙烯产率降低的原因可能是______。
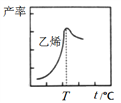
A.催化剂M的活性降低 B.①反应的平衡常数变大
C.②反应的活化能增大 D.生成甲醚的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与化学密切相关,表中对应系错误的是w.w.w.k.s.5.u.c.o.m
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中![]() 和
和![]() [或
[或![]() 和
和![]() ]的关系如图所示。下列说法不正确的是
]的关系如图所示。下列说法不正确的是
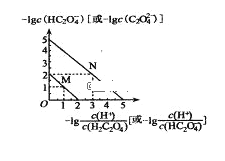
A. 曲线M表示![]() 和
和![]() 的关系
的关系
B. Ka1(H2C2O4)的数量级为10-2
C. 向NaHC2O4溶液中加少量NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
A.只有第ⅡA族元素的原子最外层有2个电子
B.L电子层为奇数的所有元素都是非金属
C.第三、四、五、六周期元素的数目分别是18、18、32、32
D.由左至右第8、9、10三列元素中没有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
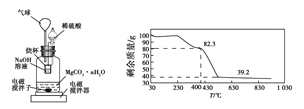
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,
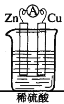
其正极反应式:_________________________;负极反应式: ____________;总反应方程式:_________________。若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成原电池,回答下列问题。
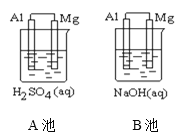
(1)该装置是把___________ 能转化为_________能的装置。
(2)A池中Mg电极是__________(填“正”或“负”)极,其在反应中_____(填“得到”或“失去”)电子,该极发生的反应是__________(填“氧化”或“还原”)反应,其电极反应为________________________,该装置中电流的方向是由_____到 ______。
(3)B池中负极材料是_________,该装置中电子的移动方向是由_____到 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com