
【题目】下列说法正确的是
A. 0.1molFe溶于硝酸,电子转移数目一定为0.3![]()
B. 标准状况下,14.4g正戊烷(![]() )中含C-C键数目为0.8N
)中含C-C键数目为0.8N
C. 18g重水(![]() )中含中子数目为10
)中含中子数目为10![]()
D. 12g熔融![]() 中含离子总数目为0.3
中含离子总数目为0.3![]()
【答案】B
【解析】
A、铁和过量硝酸反应后变为+3价,过量铁和硝酸反应后变为+2价,故0.1molFe溶于硝酸,电子转移数目不一定为0.3![]() ,故A错误;
,故A错误;
B、一个正戊烷(![]() )分子中含C-C键4个,标准状况下,14.4g正戊烷(
)分子中含C-C键4个,标准状况下,14.4g正戊烷(![]() )物质的量为0.2mol,所以含C-C键的物质的量为0.2mol×4=0.8 mol,数目为0.8NA,故B正确;
)物质的量为0.2mol,所以含C-C键的物质的量为0.2mol×4=0.8 mol,数目为0.8NA,故B正确;
C、一个D有1个质子,一个中子,一个电子,一个![]() 分子含有10个中子,
分子含有10个中子,![]() 的相对分子质量是20,所以18g
的相对分子质量是20,所以18g![]() 物质的量有0.9mol,故18g重水(
物质的量有0.9mol,故18g重水(![]() )中含中子数目9
)中含中子数目9![]() ,故C错误;
,故C错误;
D、NaHSO4在熔化状态下只能电离成Na+、HSO4-,12 g NaHSO4在熔融时离子总数为0.2NA,故D错误。
正确答案选B。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。回答:
⑴准确称取一定质量的固体NaOH配成250 mL标准溶液。需要的仪器有天平、烧杯、量筒、玻璃棒、____________、____________(填仪器名称)。
⑵若选择酚酞作指示剂,滴定时左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________________。到达滴定终点时的现象是:__________________________.
⑶下列各项操作可能会给实验结果造成误差,请用A.偏高;B.偏低;C.无影响填写(填序号)
①将NaOH溶液放入锥形瓶时,加入少量蒸馏水稀释 ______,
②酸式滴定管装入盐酸前未用该盐酸润洗 ______,
③滴定前读数时仰视,滴定完毕读数时俯视 ______,
④滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 _____,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
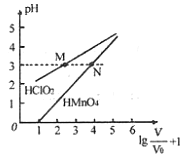
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________;![]() 的核外电子排布式为_____________________。
的核外电子排布式为_____________________。
(2)![]() 溶液可用于检验_________(填离子符号);
溶液可用于检验_________(填离子符号);![]() 中碳原子杂化轨道类型为_____;1mol
中碳原子杂化轨道类型为_____;1mol![]() 含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)某M原子的外围电子排布式为![]() ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。

①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________(填“离子”或“共价”)化合物。
③已知该晶体的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构):


(1)C60、金刚石和石墨三者的关系是互为________。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于___(填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是___。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是______NA个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com