
【题目】在2L密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)![]() zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4
B.B物质的转化率是20%
C.A的平衡浓度是1.6mol/L
D.平衡时气体压强是原来的![]()
【答案】A
【解析】
A.根据反应速率之比等于化学计量数之比来确定化学计量数。由3A(g)+2B(g)![]() zC(g)+2D(g),且v(D)=0.2mol/(L·min),则v(C)=
zC(g)+2D(g),且v(D)=0.2mol/(L·min),则v(C)= =0.4mol/(L·min),v(D):v(C)= 0.2:0.4=1:2,则z=4,故A正确;
=0.4mol/(L·min),v(D):v(C)= 0.2:0.4=1:2,则z=4,故A正确;
B.由反应 3A(g) + 2B(g) = 4C(g) + 2D(g),
开始量 4 2 0 0
变化量 1.2 0.8 1.6 0.8
平衡量 2.8 1.2 1.6 0.8
所以B的转化率=![]() ,故B错误;
,故B错误;
C. A的平衡浓度=![]() = 1.4mol/L,故C错误;
= 1.4mol/L,故C错误;
D.气体物质的量之比等于压强之比,平衡时气体压强是原来的=![]() =
=![]() ,故D错误;
,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】反应X(g)![]() 4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
200/℃ | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
T/℃ | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
下列有关该反应的描述正确的是
A. 在200℃时,4min内用Y表示的化学反应速率为0.1125mol·L-1·min-1
B. T℃下,6min时反应刚好达到平衡状态
C. 根据上表内 X 的浓度变化,可知浓度越大,反应速率越大
D. 从表中可以看出T <200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收

(1)含铝滤液中,铝元素的存在形式为________(写化学式);硅在过程_____(填序号)与钴分离。
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式____________________________。
(3)过程③Na2CO3的主要作用为________________________________________。
Ⅱ.电解法制得钴铁合金
(4)配制 0.050molL-1 FeSO4和0.025molL-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为____________________________________。
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为______________________________________________。
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:______________________(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲溶液加入(或通入)物质乙(乙物质为气体或溶液),生成沉淀的质量与消耗乙的质量关系曲线符合图的是

A.向Na[Al(OH)4]溶液中通入二氧化碳
B.向Na[Al(OH)4]溶液中滴加盐酸
C.向澄清石灰水中通入二氧化碳
D.向Al2(SO4)3溶液中滴加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A.①③④⑤B.①④⑤C.③④⑤D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图,下列有关说法正确的是

A.该流程中,原料A可以是盐酸,也可以是氢氧化钠溶液
B.步骤2 中要发生的反应有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4] -、H++OH-=H2O
C.滤液3中的主要离子有碳酸根、钠离子、氯离子
D.工业上冶炼铝用氧化铝不用氯化铝的原因是,氧化铝是电解质,氯化铝是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。无水乙醚微溶于水,熔点-116.3 ℃,沸点34.6 ℃,在空气中遇热易爆炸。实验室合成乙醚的原理如下:
主反应:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应:CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O
(乙醚制备)装置设计如图所示(部分装置略):
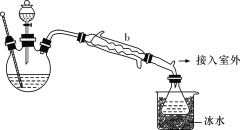
(1)仪器b应更换为下列中的________(填字母代号)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为________(填字母代号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物
c.检查装置气密性 d.熄灭酒精灯
e.通冷却水并加热烧瓶 f.拆除装置
g.控制滴加乙醇速率与馏出液速率相等
(3)反应温度不超过145 ℃,其目的是____________________。
(乙醚提纯)
![]()
(4)操作a的名称是__________;进行该操作时,必须用水浴加热代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
①2 s内用物质A表示的平均反应速率为________________。
②2 s内用物质B表示的平均反应速率为__________________________。
③2 s时物质B的转化率为______________________。
④x=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com