
【题目】根据要求填空:
(1)氧化还原反应的本质是 , 通常可用元素化合价的升降来判断氧化剂、还原剂.所含元素化合价升高的物质是剂,发生反应.
(2)写出用稀氢氧化钠吸收氯气反应的离子方程式:
(3)0.1mol/L的Na2CO3溶液的含义是(填字母)
A.1L水中含有0.1mol Na2CO3
B.1L溶液中含有10.6g Na2CO3
C.将10.6g Na2CO3溶于1L水配成的溶液
D.1L溶液中含有0.2mol Na+
(4)关于钠及其化合物的叙述正确的是(填字母)
A.钠元素在自然界中都是以化合态存在
B.钠着火时可以用湿布盖灭
C.实验室少量的钠应保存在煤油或石蜡油中
D.实验中剩余的过氧化钠粉末可以用纸包裹好后,放入垃圾桶内
(5)下列反应的离子方程式书写不正确的是(填字母)
A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32﹣=CaCO3↓
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42﹣=BaSO4↓
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+=Mg2++2H2O
D.氢氧化钡溶液与盐酸的反应:OH﹣+H+=H2O
E.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
F.碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑
【答案】
(1)电子转移;还原;氧化
(2)2OH﹣+Cl2=Cl﹣+ClO﹣+H2O
(3)BD
(4)AC
(5)BE
【解析】解:(1)氧化还原反应的本质是电子转移;在氧化还原反应中失电子化合价升高的反应物的还原剂,在反应中发生氧化反应,被氧化,所以答案是:电子转移;还原;氧化;(2)氯气和NaOH反应生成NaCl、NaClO和水,离子方程式为2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,所以答案是:2OH﹣+Cl2=Cl﹣+ClO﹣+H2O;(3)A.1L溶液中含有0.1molNa2CO3 , 而不是1L水中含有0.1mol碳酸钠,故A错误; B.10.6g碳酸钠的物质的量是0.1mol,1L溶液中含有10.6g Na2CO3 , 根据C= ![]() 知,其物质的量浓度是0.1mol/L,故B正确;
知,其物质的量浓度是0.1mol/L,故B正确;
C.将10.6g Na2CO3溶于水配成1L溶液,所得溶液物质的量浓度的0.1mol/L,溶于1L水导致溶液体积大于1L,其浓度小于0.1mol/L,故C错误;
D.钠离子n=2×0.1mol/L×1L=0.2mol,故D正确;
故选BD;(4)A.钠性质很活泼,极易和空气中氧气、水反应,所以钠元素在自然界中都是以化合态存在,故A正确;
B.钠能和水反应生成氢气,所以不能用湿布盖灭,应该用沙土盖灭,故B错误;
C.钠密度大于煤油和石蜡,且和煤油、石蜡不反应,钠极易和水、氧气反应,所以应该用煤油、石蜡贮存钠,故C正确;
D.过氧化钠和水反应生成氢氧化钠和氧气,氧气具有助燃性,同时放出大量热,所以剩余的过氧化钠不能随便丢弃,故D错误;
故选AC;(5)A.氯化钙溶液与碳酸钠溶液反应,二者生成碳酸钙沉淀,离子方程式为Ca2++CO32﹣=CaCO3↓,故A正确;
B.漏掉生成氢氧化铜的反应,离子方程式为Cu2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Cu(OH)2↓,故B错误;
C.氢氧化镁与稀盐酸反应生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故C正确;
D.氢氧化钡溶液与盐酸的反应生成弱电解质水,离子方程式为OH﹣+H+=H2O,故D正确;
E.电荷不守恒,离子方程式为Cu+2Ag+=Cu2++2Ag,故E错误;
F.碳酸钙溶于稀盐酸,二者反应生成可溶性氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故F正确;
故选BE.
【考点精析】解答此题的关键在于理解钠的化学性质的相关知识,掌握钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应.


科目:高中化学 来源: 题型:
【题目】下列应用不涉及氧化还原反应的是
A.铝热法冶炼难熔金属
B.工业上电解熔融状态Al2O3制备Al
C.Na2O2用作呼吸面具的供氧剂
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)白色沉淀E的化学式____________。
(2)写出A---B的化学方程式_____________________。
(3)写出C---D在溶液中发生氧化还原反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是( )
A.所含分子数目相同
B.所含氢原子物质的量之比为3:4
C.质量之比为16:17
D.密度之比为17:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,部分性质及转化关系如下图:

请回答:
(1)D中官能团的名称是_____________。
(2)A→B的反应类型是________________。
A.取代反应B.加成反应 C.氧化反应 D.还原反应
(3)写出A→C反应的化学方程式_______________________。
(4)某烃X与B是同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
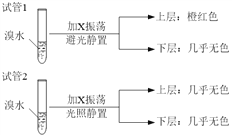
有关X的说法正确的是_______________________。
A.相同条件下,X的密度比水小
B.X的同分异构体共有6种
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是
A. 向豆浆中加入卤盐做豆腐
B. 往氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
C. 在河流入海口易形成沙洲
D. 观看电影时,从放映机到银幕有明显的光路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.糖类、油脂、蛋白质均能发生水解反应
C.铁粉和维生素 C 均可作食品袋内的脱氧剂
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3 C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com