
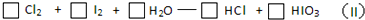
| 33.6L |
| 22.4L/mol |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
| A、1molH2含有的电子数 |
| B、通常状况下,22.4LCO2所含的分子数 |
| C、0.012kg12C所含的原子数 |
| D、1LO.5mol?L-1的CaCl2溶液所含的Cl-数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:NH4+、K+、Ba2+、Cl- |
| B、在滴加石蕊试液显红色的溶液中:K+、NH4+、CO32-、SO42- |
| C、有NO3-存在的溶液中:H+、Ba2+、Cl-、SO32- |
| D、在c(H+)=1.0×10-3mol?L-1的溶液中:Na+、K+、SO42-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2SO3) |
| c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol?L-1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol?L-1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com